
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
分析 A.10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性;
B.10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合得到等浓度的NaCl和NH3•H2O混合溶液,溶液显碱性;
C.10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合恰好反应生成CH3COONa,醋酸根离子水解溶液显碱性;
D.10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合反应生成CH3COOH、NaCl和HCl,溶液显酸性;
解答 解:A.10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性,c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合得到等浓度的NaCl和NH3•H2O混合溶液,溶液显碱性,c(Na+)=c(Cl-)>c(OH-)>c(H+),故B正确;
C.10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合恰好反应生成CH3COONa,醋酸根离子水解溶液显碱性,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合反应生成CH3COOH、NaCl和HCl,溶液显酸性,c(Cl-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了酸碱反应后溶液酸碱性的分析判断,主要是溶液中离子浓度大小比较方法,题目难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
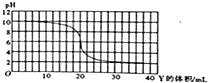
| A. | X和Y可能是KOH和CH3COOH | |
| B. | X和Y可能是NH3•H2O和HCl | |
| C. | X和Y恰好中和时,溶液呈中性 | |
| D. | X和Y恰好完全反应时的溶液中由水电离出的c(H+)=1×10-8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
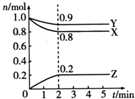 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )| A. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| B. | 反应开始到2min,X的物质的量浓度减少了0.4 mol•L-1 | |
| C. | 反应开始到2min,用Y表示的反应速率为0.1mol•L-1•min-1 | |
| D. | 反应到2min时,Z的物质的量浓度为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
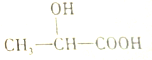
| A. | 1mol乳酸可以与足量的NaHCO3反应生成1molCO2 | |
| B. | 1mol乳酸可以与足量的钠反应生成1mol氢气 | |
| C. | 乳酸可以在一定条件下发生消去反应生成CH2=CHCOOH | |
| D. | 乳酸可以与NaOH溶液反应生成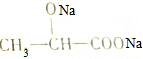 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | |||||
| 4 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:Z>X=R>Y | |
| B. | Z与R形成的化合物中R显正价 | |
| C. | 离子半径:X2->Y+>R2->Z- | |
| D. | 四种元素中X元素形成的氢化物沸点最低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com