
分析 (1)根据葡萄糖发生银镜反应的方程式进行计算;
(2)根据葡萄糖与醋酸反应的方程式进行计算;
(3)根据葡萄糖的氧化反应来计算.
解答 解:(1)因葡萄糖发生银镜反应的方程式为:CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH $\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O,
所以1mol葡萄糖反应时需银氨溶液2mol,生成2molAg,反应后变为葡萄糖酸铵:CH2OH(CHOH)4COONH4,
故答案为:2;葡萄糖酸铵;CH2OH(CHOH)4COONH4;
(2)因葡萄糖与醋酸反应生成酯的方程式为:CH2OH(CHOH)4CHO+5CH3COOH→CH3COOCH2(CH3COOCH)4CHO+5H2O,
1mol葡萄糖参加反应,需要5mol乙酸,其质量为:5mol×60g/mol=300g,故答案为:300;
(3)葡萄糖在人体内缓慢氧化:C6H12O6+6O2→6CO2+6H2O,1mol葡萄糖参加反应,需要6mol氧气,其体积为:6mol×22.4L/mol=134.4L,
故答案为:134.4;C6H12O6+6O2→6CO2+6H2O.
点评 本题主要考查了化学方程式的书写与计算,书写方程式时抓住官能团很重要.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中只含有共价键,离子晶体中只含有离子键 | |
| B. | 原子晶体的熔点一定比金属晶体的高 | |
| C. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在单质中一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 化学键断裂一定伴随着化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应及实验目的 | 试剂X | 试剂Y |
| A | 电石与饱和食盐水混合, 检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
| B | 二氧化锰与浓盐酸混合加热, 验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
| C | 乙醇与浓硫酸加热至170℃, 证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 |
| D | 乙酸溶液与碳酸钠固体混合, 探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
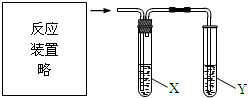
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 变化的化学方程式是:NaCl03+KCl=KClO3(结晶)+NaCl | |
| B. | KClO3是难溶物 | |
| C. | KClO3是比NaClO3更弱的电解质 | |
| D. | 相同温度下,KCl03的溶解度比NaCl03小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
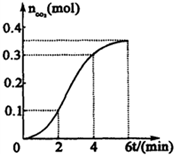 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内形成x mol的A-A键,同时形成x mol的A-B键 | |
| B. | 容器内的总压强不随时间变化,气体的密度不再随时间变化 | |
| C. | A2、AB、B2的浓度不再随时间改变 | |
| D. | 单位时间内生成x mol的A2分子,同时生成x mol的B2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com