
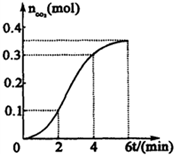
 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:分析 (1)v=$\frac{△c}{△t}$来求解;同一容器中单位时间同一物质的物质的量变化越大反应速率越快,据图分析,反应速率逐渐加快,说明反应放热;
(2)据生成二氧化碳物质的量,计算标况下的体积;
(3)据生成二氧化碳物质的量,计算反应的盐酸的物质的量,求算v(H+);
(4)从反应的热效应分析解答;
(5)不增加氢离子的浓度,不增加接触面积.
解答 解:(1)0-2min,生成二氧化碳0.1mol,2-4min,生成二氧化碳0.2mol,4-6min,生成二氧化碳0.1mol,相同时间内,2-4min产生气体最多,速率最快,
故答案为:B;
(2)据生成二氧化碳物质的量,=n(CO2)=0.35mol,所以V(CO2)=0.35mol×22.4L/mol=7.84L,
故答案为:7.84;
(3)在0~2min内生成二氧化碳0.1mol,则参加反应的HCl物质的量为0.2mol,v(H+)=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{0.5L}}{2min}$=0.2mol/(L•min),
故答案为:0.2mol/(L•min);
(4)在0~2min反应速率逐渐增大的原因可能是,随反应进行,反应速率加快,说明反应放热反应,温度升高反应速率加快,
故答案为:反应为放热反应;
(5)不能使该反应速率增大的是:不增加氢离子的浓度,不增加接触面积
A.用500mL 2.0mol/L 稀硫酸代替稀盐酸,生成微溶的硫酸钙,反应速率减慢,故A正确;
B.改用1000mL2.0mol/L 的稀盐酸,氢离子浓度不变,速率不变,故B正确;
C.改用250mL 4.0mol/L 的稀盐酸,浓度变大速率加快,故C错误;
D.将CaCO3颗粒改为粉末,接触面积增大,加快反应速率,故D错误;
故答案为:AB.
点评 本题考查化学反应速率的计算,以及影响化学反应速率的因素,注意第(5)题硫酸与碳酸钙的反应生成微溶物,使速率减慢,题目难度适中.


科目:高中化学 来源: 题型:选择题
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、 -2 | +2 | -2 | +1 |
| A. | K、L、M三元素的金属性逐渐增强 | |
| B. | T元素的化合价除了-2价,只有0价 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物为淡黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
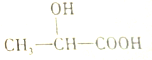
| A. | 1mol乳酸可以与足量的NaHCO3反应生成1molCO2 | |
| B. | 1mol乳酸可以与足量的钠反应生成1mol氢气 | |
| C. | 乳酸可以在一定条件下发生消去反应生成CH2=CHCOOH | |
| D. | 乳酸可以与NaOH溶液反应生成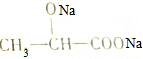 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响; b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | |||||
| 4 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的氯化钠可制取金属钠,电解熔融的氧化铝可制取金属铝 | |
| B. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 | |
| C. | 在镀件上电镀锌,用锌作阳极,镀件作阴极 | |
| D. | 电解法精炼粗铜,用纯铜作阳极,粗铜阴极,CuSO4溶液为电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
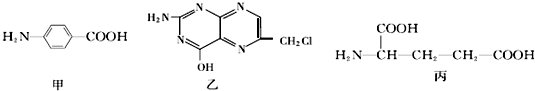
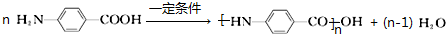
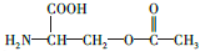 .
.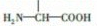 片段
片段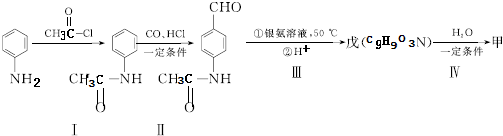
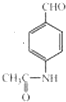 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$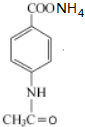 +3NH3+2Ag+H2O.
+3NH3+2Ag+H2O.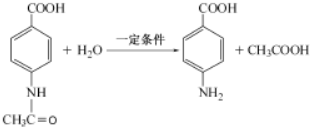 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com