
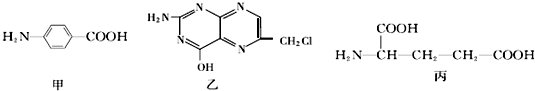
 .
. 片段
片段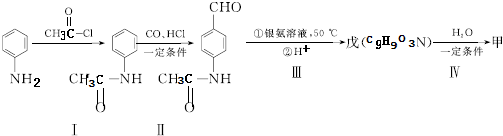
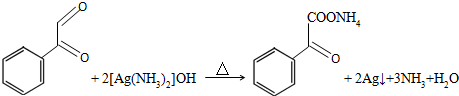
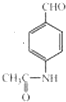 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$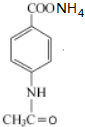 +3NH3+2Ag+H2O.
+3NH3+2Ag+H2O.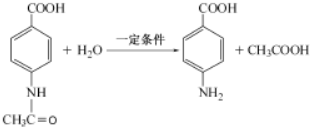 .
. 分析 (1)氨基显碱性、羧基显酸性;
(2)氨基与羧基之间发生缩聚反应生成高分子化合物;
(3)a.该分子中C、N原子个数分别是7、5;
b.含有苯环的有机物属于芳香族化合物;
c.氨基能和酸反应,氯原子能和碱溶液反应;
d.该分子中含有N原子,且不含苯环;
(4)丙的同分异构体丁中含有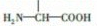 、在稀硫酸中水解有乙酸生成,说明丁含有酯基,丁为乙酸某酯;
、在稀硫酸中水解有乙酸生成,说明丁含有酯基,丁为乙酸某酯;
(5)苯胺和CH3COCl发生取代反应生成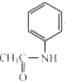 ,
, 在一定条件下与CO发生加成反应生成
在一定条件下与CO发生加成反应生成 ,
, 和银氨溶液发生氧化反应然后酸化得到戊,戊的结构简式为
和银氨溶液发生氧化反应然后酸化得到戊,戊的结构简式为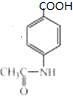 ,戊发生水解反应生成甲.
,戊发生水解反应生成甲.
解答 解:(1)氨基显碱性、羧基显酸性,所以甲中显碱性的官能团是氨基,
故答案为:氨基;
(2)氨基与羧基之间发生缩聚反应生成高分子化合物,反应方程式为: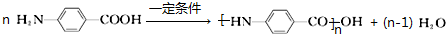 ,
,
故答案为: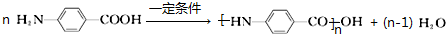 ;
;
(3)a.该分子中C、N原子个数分别是7、5,所以分子中碳原子与氮原子的个数比是7:5,故正确;
b.含有苯环的有机物属于芳香族化合物,该分子中没有苯环,所以不属于芳香族化合物,故错误;
c.氨基能和酸反应,氯原子能和碱溶液反应,所以该物质既能与盐酸又能与氢氧化钠溶液反应,故正确;
d.该分子中含有N原子,且没有苯环,不属于苯酚的同系物,故错误,
故选:ac;
(4)丙的同分异构体丁中含有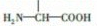 、在稀硫酸中水解有乙酸生成,说明丁含有酯基,丁为乙酸某酯,所以丁的结构简式为
、在稀硫酸中水解有乙酸生成,说明丁含有酯基,丁为乙酸某酯,所以丁的结构简式为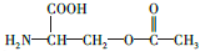 ,
,
故答案为: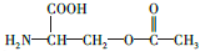 ;
;
(5)苯胺和CH3COCl发生取代反应生成 ,
, 在一定条件下与CO发生加成反应生成
在一定条件下与CO发生加成反应生成 ,
, 和银氨溶液发生氧化反应然后酸化得到戊,戊的结构简式为
和银氨溶液发生氧化反应然后酸化得到戊,戊的结构简式为 ,戊发生水解反应生成甲.
,戊发生水解反应生成甲.
①通过以上分析知,步骤Ⅰ的反应类型是取代反应,故答案为:取代反应;
②氨基不稳定,易被氧化为硝基,为保护氨基,所以设计步骤Ⅰ和Ⅳ,故答案为:保护氨基不被氧化;
③步骤Ⅲ的第一步①反应的化学方程式为: +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +3NH3+2Ag+H2O,
+3NH3+2Ag+H2O,
故答案为: +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +3NH3+2Ag+H2O;
+3NH3+2Ag+H2O;
④步骤Ⅳ发生水解反应,反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成、有机物的结构和性质、有机反应方程式的书写等,注意对基础知识的理解掌握,题目难度中等.


科目:高中化学 来源: 题型:填空题
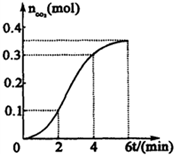 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内形成x mol的A-A键,同时形成x mol的A-B键 | |
| B. | 容器内的总压强不随时间变化,气体的密度不再随时间变化 | |
| C. | A2、AB、B2的浓度不再随时间改变 | |
| D. | 单位时间内生成x mol的A2分子,同时生成x mol的B2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
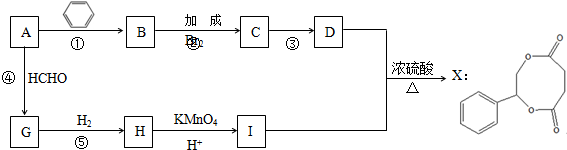
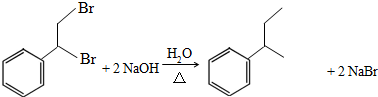 .
. .
.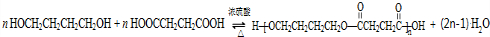 .
. 任意2种.
任意2种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

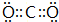 ,其中②原子的杂化方式为sp.
,其中②原子的杂化方式为sp.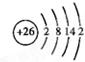 ,⑪原子的价电子排布式是4s24p3
,⑪原子的价电子排布式是4s24p3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
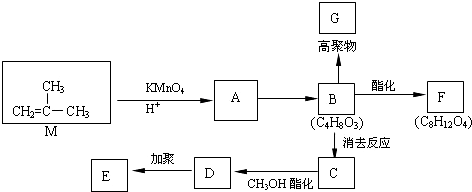
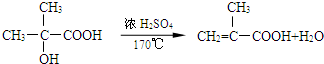 .②D→E的化学方程式
.②D→E的化学方程式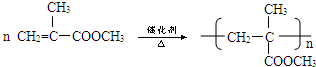 .
. ,
,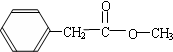 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,存在转化关系:甲$\stackrel{强酸溶液}{←}$丙$\stackrel{强碱溶液}{→}$乙
由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,存在转化关系:甲$\stackrel{强酸溶液}{←}$丙$\stackrel{强碱溶液}{→}$乙查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂、钠、钾、铷、铯都具有碱性,故称为碱金属 | |
| B. | 石灰石、纯碱、小苏打、碳酸铵热稳定性最强的是纯碱 | |
| C. | 过氧化钠投入到饱和碳酸钠溶液既能产生白色沉淀,又能产生气体 | |
| D. | 金属Li是密度最小的碱金属,熔点大于Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,若阳极有64g铜放电溶解,则理论上电路中转移的电子数为2NA | |
| B. | 7.8g Na2O2与Na2S的混合物中含有的阴、阳离子的总数为0.3NA | |
| C. | 0.1 mol/LNa2CO3溶液中所含阴离子的总数大于0.1NA | |
| D. | 标准状况下22.4L三氯甲烷含有氯原子的数目是3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com