
【题目】下列叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 分子式符合C5H11Cl的化合物有6种
C. 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3
D. 菲的结构简式为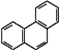 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
【答案】B
【解析】
A、根据甲苯苯环上氢原子的种类结合3个碳原子的烷基有两种解答;
B、根据戊烷分子中氢原子的种类判断;
C、根据替代法分析判断;
D、根据菲分子中氢原子种类判断。
A、甲苯苯环的H原子有3种,含3个碳原子的烷基的结构有2种,即正丙基和异丙基,所以取代后的产物的结构有2×3=6种,A正确;
B、分子式符合C5H11Cl 的化合物是戊烷的一氯代物,戊烷有3种同分异构体,正戊烷有3种H原子,异戊烷有4种H原子,新戊烷有1种H原子,所以戊烷的一氯代物有8种,B错误;
C、二氯苯与四氯苯中的H原子数之和为6,所以四氯苯与二氯苯的同分异构体的数目相同,C正确;
D、根据菲的结构简式可知,该分子中存在对称结构,所以分子中有5种H原子,则与硝酸反应后的产物有5种,D正确。
答案选B。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化等再利用。请回答:
(1)已知:①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol
②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol
③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol
④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol
反应③的a=______,反应④自发进行的条件是______(填“高温”、“低温”或“任意温度”)
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量x mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
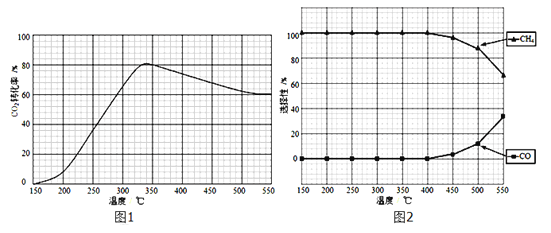
①下列说法正确的是___________。
A.△H5 小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为yL,该温度下反应I的平衡常数为____(用x、y 表示)。
(3)CO2溶于水形成H2CO3。已知常温下H2CO3 的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.75×10-5。常温下,用氨水吸收CO2 可得到NH4HCO3 溶液,NH4HCO3 溶液显______(填“ 酸 性”、“ 中性” 或“ 碱性”);请计算反应NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3 的平衡常数K=_____________。
NH3·H2O+H2CO3 的平衡常数K=_____________。
(4)据文献报道,二氧化碳可以在酸性水溶液中用情性电极电解得到乙烯,其原理如图所示。
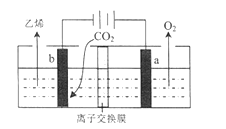
b电极上的电极反应式为____________________________,该装置中使用的是________(“ 阴”或“ 阳”) 离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.分散质粒子能作不停的、无规则的运动
B.光线透过时能观察到光亮的通路
C.静置后既不分层,也无沉淀产生
D.分散质粒子直径在10-9~10-7 m之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的转化。在转化的各阶段被破坏的粒子间的主要相互作用依次是
A. 氢键;分子间作用力;非极性键
B. 氢键;氢键;极性键[
C. 氢键;极性键;分子间作用力
D. 分子间作用力;氢键;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题: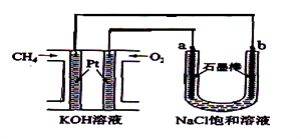
(1)甲烷燃料电池负极的电极反应为:。
(2)b电极上得到的气体是 , 电解氯化钠溶液的总反应方程式为 。
(3)若甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为L(标准状况)。
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:负极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
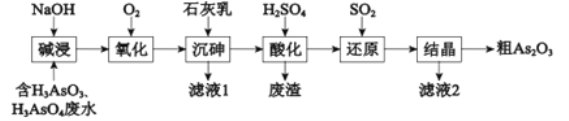
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是__________.
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2___________.
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)△H<0
Ca2+(aq)+2OH-(aq)△H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃.高于85℃后,随温度升高,沉淀率________(填“提高”或“下降”)。用化学平衡原理解释其原因是_________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_________.
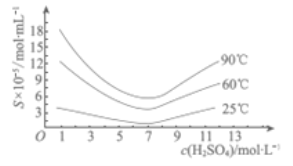
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3.As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示.为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是___________.
(6)下列说法中,正确的是__________(填字母).
a.粗As2O3中含有CaSO4
b.工业生产中,滤液1、2和废渣一同弃掉
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或断开)1 mol 化学键时释放(或吸收)的能量。已知白磷和 P4O6 的分 子结构如图所示:
现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O==O:498
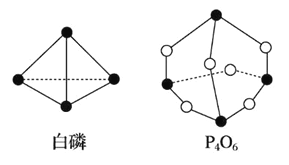
若生成 1 mol P4O6,则反应 P4(白磷)+3O2==P4O6 中的能量变化为
A. 吸收 1638 kJ 能量 B. 放出 1638 kJ 能量
C. 吸收 126 kJ 能量 D. 放出 126 kJ 能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com