
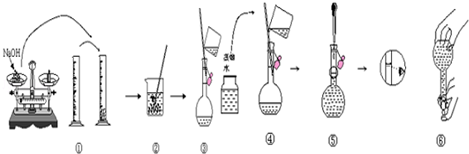
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(2)根据物质的量浓度公式计算NaOH的物质的量,进而求出其质量;
(3)依据C=$\frac{n}{V}$进行误差分析;
(4)根据溶液的配置步骤,找出错误;
(5)依据稀释前后溶质的物质的量不变,计算需要浓硫酸的体积.
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、500mL容量瓶、胶头滴管;
故答案为:玻璃棒、500mL容量瓶、胶头滴管;
(2)配制0.1mol•L-1 NaOH溶液500mL,需要氢氧化钠质量=0.1mol•L-1×0.5L×40g/mol=2.0g;
故答案为:2.0;
(3)A.容量瓶未干燥就用来配制溶液,不会产生误差,故A错误;
B.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,n减小,c减小,故B错误;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,V减小,c增大;故C正确;
D.往容量瓶转移时有少量液体溅出,n减小,c减小,故D错误;
E.未洗涤溶解NaOH的烧杯,n减小,c减小,故E错误;
F.若定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏小;故F错误;
故答案为:C;
(4)称量NaOH,应该用小烧杯,①错误;没有洗涤玻璃棒,④错误;定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏小,⑤错误;
故答案为:①④⑤;
(5)设需要浓硫酸的体积为V,依据稀释前后溶质的质量不变得:V×98%×1.84g/cm=0.25L×2.0mol/L×98g/mol,
解得:V=27.2mL;
故答案为:27.2mL.
点评 本题主要考查一定物质的量浓度溶液的配制与稀释,熟悉配制过程是解题关键,注意容量瓶、量筒规格的选取方法为易错点,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 吸热反应只有在加热的条件下才能进行 | |
| C. | 放热反应可能需要在加热的条件下才能进行 | |
| D. | 化学反应中的能量变化都只以热能的形式表现出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的碳酸钠溶液中含CO32-NA个 | |
| B. | 标准状况下,11.2L甲醇与足量钠反应,可生成标准状况下氢气5.6L | |
| C. | H2O2和H2O的混合物1mol中,含阴离子个数为NA | |
| D. | 标准状况下,22.4LCl2与足量铁充分反应,电子转移数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
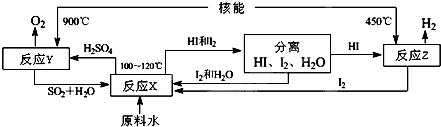
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
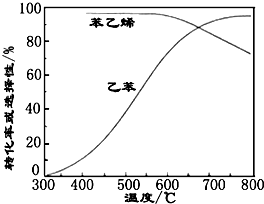
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
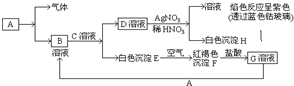 已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;
已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
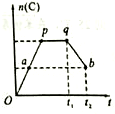 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
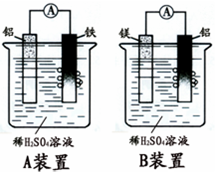 有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,
有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com