
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
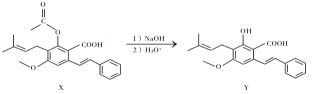
下列有关化合物X、Y的说法不正确的是
A.![]() 最多能与
最多能与![]() 反应
反应
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性![]() 溶液反应,且均存在顺反异构体
溶液反应,且均存在顺反异构体
D.室温下X、Y分别与足量![]() 加成的产物分子中手性碳原子数目相等
加成的产物分子中手性碳原子数目相等
科目:高中化学 来源: 题型:
【题目】X、Z、Q、R、T为前四周期元素,且原子序数依次增大。X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子。请回答下列问题:
(1)Z基态原子的电子排布式是______;Z所在周期元素中,最高价氧化物对应的水化物酸性最强的是______(填化学式)。
(2)利用价层电子对互斥理论判断 RZ3-的立体构型是______;RZ3-的中心原子的杂化轨道类型为______。
(3)水中T含量超标,容易使洁具和衣物染色.RZ2可以用来除去水中超标的T2+,生成黑色沉淀TZ2,当消耗0.2molRZ2时,共转移了1mol电子,则反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
B.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.H2C=CH2+HBr→CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是
A.苯与浓硝酸、浓硫酸共热并保持![]() 反应生成硝基苯
反应生成硝基苯
B.用![]() 与
与![]() 发生酯化反应,生成的有机物为
发生酯化反应,生成的有机物为![]()
C.苯乙烯在合适条件下催化加氢可生成乙基环己烷
D.戊烷![]() 的一溴取代物共有8种
的一溴取代物共有8种![]() 不含立体异构
不含立体异构![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示(已知pKa=-lgKa),下列说法正确的是
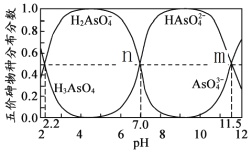
A. H3AsO4溶液pKa2为4.5
B. NaH2AsO4溶液显碱性
C. 常温下,m点对应溶液中由水电离出的OH—浓度为10—11.5 mol/L
D. n点对应溶液中,离子浓度关系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
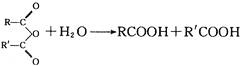
【题目】一种联合生产树脂![]() 和香料
和香料![]() 的合成路线设计如下:
的合成路线设计如下:
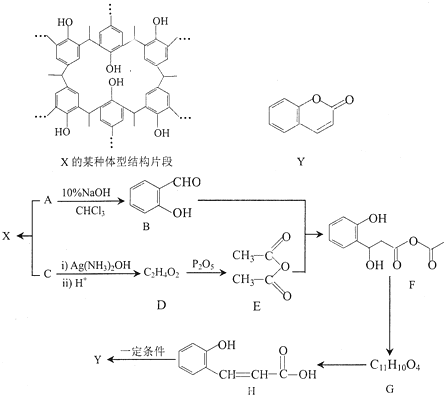
已知:![]() 是一种烃的含氧衍生物,其相对分子质量小于100,碳、氢元素质量分数之和为
是一种烃的含氧衍生物,其相对分子质量小于100,碳、氢元素质量分数之和为![]() ;
;![]()
 。回答下列问题:
。回答下列问题:
![]()
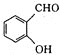 中的官能团名称为_______。
中的官能团名称为_______。
![]() 写出结构简式:A_______,D_______,G_______。
写出结构简式:A_______,D_______,G_______。
![]() 下列说法正确的是_______。
下列说法正确的是_______。
![]() 与E生成F的反应类型为加成反应
与E生成F的反应类型为加成反应![]() 最多能与
最多能与![]() 发生加成反应
发生加成反应![]() 与氢氧化钠水溶液反应时,
与氢氧化钠水溶液反应时,![]() 最多能消耗
最多能消耗![]()
![]() 生成Y的化学方程式为__________________________。
生成Y的化学方程式为__________________________。
![]() 的分子存在顺反异构,写出H的顺式异构体的结构简式:_____________________。
的分子存在顺反异构,写出H的顺式异构体的结构简式:_____________________。
![]() 尿素
尿素![]()
![]()
![]() 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物。写出尿素与C在一定条件下生成线形高分子化合物的化学方程式:_______。
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物。写出尿素与C在一定条件下生成线形高分子化合物的化学方程式:_______。
![]() 的同分异构体中,能同时满足如下条件的所有的有机物的结构简式为________________。
的同分异构体中,能同时满足如下条件的所有的有机物的结构简式为________________。![]() 不考虑立体异构
不考虑立体异构![]()
![]() 可发生银镜反应;
可发生银镜反应;![]() 只含有一个环状结构且可使
只含有一个环状结构且可使![]() 溶液显紫色;
溶液显紫色;![]() 核磁共振氢谱为四组峰,且峰面积比为
核磁共振氢谱为四组峰,且峰面积比为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,

现用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是__________。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 __________________。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是_______________。
(3)在装置C中应加入NaOH溶液,其目的是____________。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法 ______________。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置分层、分液后,若产物中有少量未反应的Br2,最好用______________洗涤除去;若产物中有少量副产物乙醚,可用________(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是________________。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,我国使用的能源主要是煤、石油、天然气等,这些能源都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测氢能将是21世纪最理想的新能源之一。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:![]()
![]()
![]()
![]()
由甲烷制氢气的一个缺点是________。
(3)将![]() 进行热分解也可以制得氢气
进行热分解也可以制得氢气![]()
![]() 。热分解制氢气时,常向反应器中通入一定比例的空气,使部分
。热分解制氢气时,常向反应器中通入一定比例的空气,使部分![]() 燃烧,其目的是_________________________。
燃烧,其目的是_________________________。
(4)镁铝合金(![]() )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的![]() 、
、![]() 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为![]() 得到的混合物
得到的混合物![]() 在一定条件下可释放出氢气。
在一定条件下可释放出氢气。
①熔炼制备镁铝合金(![]() )时通入氩气的目的是____________________________________。
)时通入氩气的目的是____________________________________。
②在足量的![]() 的
的![]() 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出![]() 。
。![]()
![]() 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出![]() 的物质的量为________。
的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com