
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2LNO和11.2LO2混合后气体的分子总数为NA
B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
【答案】C
【解析】
A.NO与O2混合后会发生化合反应生成NO2,得到的混合气体的物质的量并不是1mol,分子总数并不等于NA,故A项错误;B.由双氧水制氧气时氧元素的化合价是由-1价升高到0价,这样每生成1mol氧气转移电子为2mol,制得标准状态下4.48LO2转移的电子数为:0.2mol×2=0.4mol,故B项错误;C.乙烯的分子式为C2H4,环丙烷的分子式为C3H6,其最简式都为CH2,这样14g该混合气体中相当于含有CH2原子团的物质的量为![]() =1mol,碳原子的个数为1×NA,故C项正确;D. pH =13的Ba(OH)2溶液的体积未知,因此溶液中的OH-的数目无法求算,故D项错误;答案选C。
=1mol,碳原子的个数为1×NA,故C项正确;D. pH =13的Ba(OH)2溶液的体积未知,因此溶液中的OH-的数目无法求算,故D项错误;答案选C。


科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
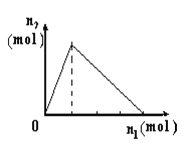
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g) +CO2 (g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______。
(3)500℃时测得反应在某时刻,H2(g)、CO2(g)、CH3OH(g)H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时V正____V逆(填“>”“=”“<”)。
(4)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示,若开始加入2mol/LH2和1mol./LCO,则B点时化学平衡常数为___________。

(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如下表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______,乙中CO2的转化率____甲。(填“大 于”、“等 于”或“小于”)
起始浓度 | 甲 | 乙 |
c(H2)/mol/L | 0.10 | 0.20 |
c(CO2 )/mol/L 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C分别代表中学化学中常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为lnm-100nm的红褐色液相分散系,则该反应的化学方程式为:_____,将A的溶液加热蒸干并灼烧,得到固体的化学式为:_____。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100mL某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为____。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_______。
(4)C是常见温室气体,将一定量的气体C通入100mL 某浓度的KOH得溶液F,向F溶液中逐滴加入2 molL-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。则F溶质与足量石灰水发生反应最多可得沉淀的质量为____g。
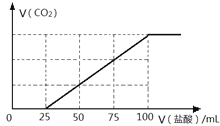
(5)pH = 3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质, C、F是无色无味的气体,H是白色沉淀,.
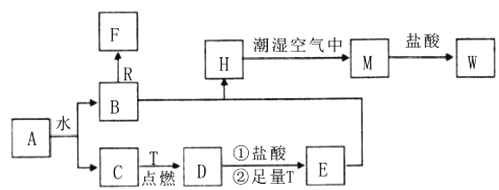
(1)H在潮湿空气中变成M的实验现象是______________,化学方程式为________。
(2)A和水反应生成B和C的离子方程式为___________________________,由此反应可知A有作为_________的用途。
(3)步骤①的离子方程式_________________________,步骤②后的离子方程式___________________请写出检验W溶液中主要阳离子所需要的试剂:_____。
(4)B和R在溶液中反应生成F的离子方程式为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molA和3molB充入一密闭的容器中发生反应:aA(g)+B(g)![]() C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
A. a="3" B. a="2" C. B的转化率为40% D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,其结构简式如图所示。下列说法不正确的是( )

A. CPAE能发生取代反应、加成反应
B. CPAE能使酸性高锰酸钾溶液褪色
C. CPAE可与氢氧化钠溶液发生反应
D. CPAE在酸性条件下水解得到相对分子质量较小的有机物的同分异构体共有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
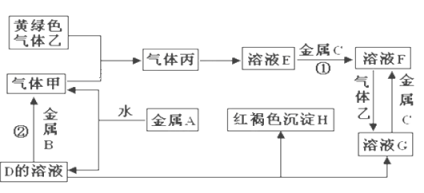
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A__________;H______;G_______;乙_______;
(2)写出下列反应的化学方程式
反应①_____________________________________________________
反应②_____________________________________________________
(3)F溶液与气体乙反应的离子方程式______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com