工业上制取氯气大多采用电解饱和食盐水的方法,以此为基础的工业称为“氯碱工业”,它是化学工业的一个重要支柱.电解饱和食盐水可产生氯气、氢气和氢氧化钠.
(1)若电解饱和食盐水消耗NaCl 117g,计算理论上最多可制得氯气的体积(标准状况).
(2)因氯气有毒,制氯气时需用氢氧化钠溶液来吸收尾气,若将7.1g氯气用氢氧化钠溶液完全吸收,需消耗0.5mol/L NaOH溶液的体积为多少?
【答案】
分析:(1)令电解117g氯化钠生成氯气的体积为VL,根据2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑计算;
(2)令需要氢氧化钠的物质的量为nmol,根据2NaOH+Cl
2=NaCl+NaClO+H
2O计算n,再根据V=
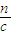
计算氢氧化钠溶液的体积.
解答:解:(1)令电解117g氯化钠生成氯气的体积为VL,则:
2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑
117g 22.4L
117g VL
故V=22.4
答:生成氯气的体积为22.4L;
(2)令需要氢氧化钠的物质的量为nmol,则:
2NaOH+Cl
2=NaCl+NaClO+H
2O计算n,
2mol 71g
nmol 7.1g
所以2mol:nmol=71g:7.1g,解得:n=0.2
故需要氢氧化钠溶液的体积为:
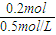
=0.4L=400mL
答:需要需消耗0.5mol/L NaOH溶液的体积400mL.
点评:本题考查学生利用化学反应方程式的计算,明确发生的化学反应及物质的量的有关计算公式即可解答,题目难度不大.

 2NaOH+H2↑+Cl2↑计算;
2NaOH+H2↑+Cl2↑计算;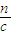 计算氢氧化钠溶液的体积.
计算氢氧化钠溶液的体积. 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑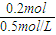 =0.4L=400mL
=0.4L=400mL

 阅读快车系列答案
阅读快车系列答案