
【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D
【答案】B
【解析】
A.Mg(HCO3)2溶液中加入足量NaOH溶液,反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO3+4OH═Mg(OH)2↓+2CO32+2H2O,故A错误;
B.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为1mol、2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO2+5H+═Al3++Al(OH)3↓+H2O,故B正确;
C.Fe3O4与过量的稀HNO3反应,生成的亚铁离子被稀硝酸氧化成了铁离子,正确的离子方程式为:3Fe3O4+NO3+28H+═9Fe3++14H2O+NO↑,故C错误;
D.NaClO溶液与FeCl2溶液混合,二者发生氧化还原反应,正确的离子反应为:2Fe2++5ClO+5H2O═2Fe(OH)3↓+Cl+4HClO,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中,X、Y、Z 三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析
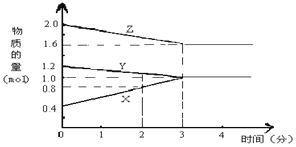
(1)该反应的化学方程式为________。
(2)反应开始至2min末,X的反应速率为_________。
(3)该反应____________。(填序号)
①是可逆反应
②不是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-akJ·mol-1(a>0)
(1)KI溶液可作为H2O2分解反应的催化剂,催化过程按以下两步反应进行:
Ⅰ.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0)
Ⅱ.__ ΔH2=__kJ·mol-1(用含a和b的代数式表示)
①请将上述过程补充完整(提示:反应Ⅱ不是分解反应)。
②已知:相同条件下,反应Ⅰ的反应速率小于反应Ⅱ的反应速率。如图为未加催化剂时H2O2分解反应的能量-反应历程示意图,请在图中画出加入KI溶液后该反应的能量-反应历程示意图___。
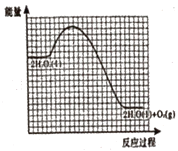
(2)H2O2的水溶液呈弱酸性,其电离过程如下:H2O2H++HO2-;HO2-H++O22-
某温度下,其电离平衡常数K1=1.1×10-11,则质量分数为30%(物质的量浓度为10mol·L-1)的H2O2水溶液的pH≈__。(忽略H2O2的二级电离及水的电离)。
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度![]() ,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
A.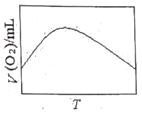 B.
B.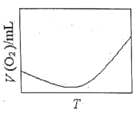
C.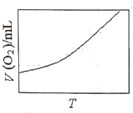 D.
D.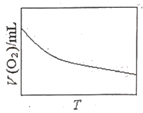
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的短周期元素,且
是原子序数依次增大的短周期元素,且![]() 原子序数之和是
原子序数之和是![]() 原子序数之和的
原子序数之和的![]() 。甲、乙、丙、丁是由这些元素组成的二元化合物,
。甲、乙、丙、丁是由这些元素组成的二元化合物,![]() 是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物
是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物![]() 是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 由四种元素形成的两种盐,水溶液中反应能生成![]()
B. ![]() 与
与![]() 形成的化合物中阴、阳离子个数比可为1:1
形成的化合物中阴、阳离子个数比可为1:1
C. 化合物![]() 、乙烯使溴水褪色的原理相同
、乙烯使溴水褪色的原理相同
D. ![]() 与
与![]() 形成的化合物中,成键原子均满足8电子结构
形成的化合物中,成键原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为
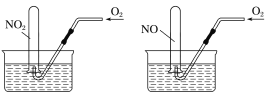
A.1∶1B.5∶7C.7∶5D.4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
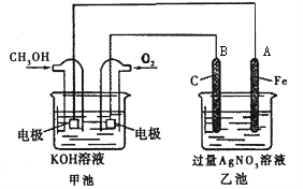
(1)放电时:正极参加反应气体22.4L(标准状况下),则转移电子的物质的量为___。
(2)在此过程中若完全反应,乙池中A极的质量增加216 g,则乙池中c(H+)=______(反应后溶液体积为2000mL)。
(3)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
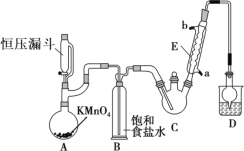
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法错误的是()
A. 常温常压下,4gD2O中含有的电子数为2NA
B. 42gC2H4和C4H8的混合气中含有氢原子数为6NA
C. 25℃时,pH=1的H3PO4溶液中含有H+数为0.1NA
D. H2O(g)通过Na2O2(s)使其增重bg时,反应中转移的电子数为bNA/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A和B两种可溶性盐组成的混合物,进行了下列实验:
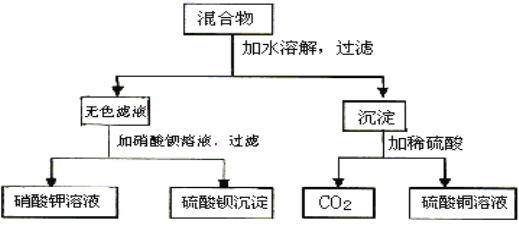
(1)若A溶液有颜色,试判断,A、B分别是_____________、_____________。(写化学式)
(2)写出实验过程中发生反应的离子方程式_____________、_____________、_____________。(顺序不限)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com