
【题目】由A和B两种可溶性盐组成的混合物,进行了下列实验:
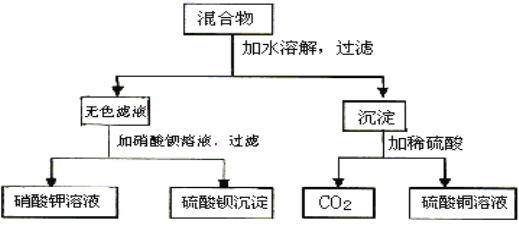
(1)若A溶液有颜色,试判断,A、B分别是_____________、_____________。(写化学式)
(2)写出实验过程中发生反应的离子方程式_____________、_____________、_____________。(顺序不限)
【答案】CuSO4 K2CO3 Cu2++CO32-=CuCO3↓ Ba2++SO42-=BaSO4↓ CuCO3+2H+=Cu2++CO2↑+H2O
【解析】
A和B两种可溶性盐组成的混合物,加水溶解后,过滤后所得无色溶液加入硝酸钡溶液可得硫酸钡沉淀和硝酸钾溶液,说明混合物中含有SO42-、K+;混合物加水溶解过滤所得沉淀加入稀硫酸得CO2,说明混合物中含有CO32-,最后得到硫酸铜溶液,则混合物中含有Cu2+;则混合物中含有:SO42-、Cu2+、CO32-、K+;这些离子可以组成两种可溶性物质是K2CO3、CuSO4,据此分析解答。
(1)根据分析,A、B两种可溶性物质是K2CO3、CuSO4,若A溶液有颜色,A为CuSO4、B为K2CO3;
(2)A、B两种盐K2CO3、CuSO4在溶解时,发生反应生成碳酸铜和硫酸钾,离子反应为:Cu2++CO32-=CuCO3↓,过滤后的溶液中加入硝酸钡,生成硫酸钡和硝酸钾,离子反应为:Ba2++SO42-=BaSO4↓,过滤得到的沉淀为碳酸铜,加入稀硫酸生成硫酸铜、二氧化碳和水,离子反应为:CuCO3+2H+=Cu2++CO2↑+H2O。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________mol·L-1。(保留小数点后一位)
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A、容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
C、需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________mol·L-1。
②需用浓硫酸的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满N2重114g,若充满CO2重122g,现充满某气体重108g,则某气体的相对分子质量为
A.28B.32C.44D.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_______,提供孤电子对的成键原子是________。
(3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)理论上任何一个自发的氧化还原反应均可以设计成原电池。根据氧化还原反应Fe+2Fe3+=3Fe2+设计的原电池如图所示,其中盐桥内装琼脂饱和KNO3溶液。
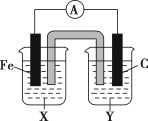
请回答下列问题:
①电解质溶液X是___;电解质溶液Y是___。
②写出两电极的电极反应式:铁电极:_;碳电极:__。
③外电路中的电子是从__电极流向__电极。(填“铁”或“碳”)
④盐桥中向X溶液中迁移的离子是__(填字母):A.K+ B.NO3-
(2)请将下列氧化还原反应3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O设计成原电池,画出(1)中的装置图,并写出相应的电极反应式。
①原电池装置图:_______;
②正极:_________;
③负极:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com