
【题目】(1)理论上任何一个自发的氧化还原反应均可以设计成原电池。根据氧化还原反应Fe+2Fe3+=3Fe2+设计的原电池如图所示,其中盐桥内装琼脂饱和KNO3溶液。
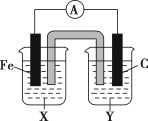
请回答下列问题:
①电解质溶液X是___;电解质溶液Y是___。
②写出两电极的电极反应式:铁电极:_;碳电极:__。
③外电路中的电子是从__电极流向__电极。(填“铁”或“碳”)
④盐桥中向X溶液中迁移的离子是__(填字母):A.K+ B.NO3-
(2)请将下列氧化还原反应3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O设计成原电池,画出(1)中的装置图,并写出相应的电极反应式。
①原电池装置图:_______;
②正极:_________;
③负极:_________。
【答案】FeCl2(或FeSO4) FeCl3[或Fe2(SO4)3] Fe-2e-=Fe2+ 2Fe3++2e-=2Fe2+ 铁 碳 B 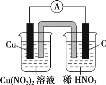 NO3-+3e-+4H+=NO↑+2H2O Cu-2e-=Cu2+
NO3-+3e-+4H+=NO↑+2H2O Cu-2e-=Cu2+
【解析】
(1)根据反应Fe+2Fe3+=3Fe2+分析,在反应中,Fe失电子,被氧化,Fe3+得电子,被还原;原电池中负极失电子发生氧化反应,Fe3+在正极上得电子被还原;外电路中的电子从负极流向正极,盐桥中的阴离子往负极移动,阳离子往正极移动,以此解答;
(2)根据原电池中负极失电子发生氧化反应,正极得电子发生还原反应,电解质一般为参与反应的离子所组成的化合物分析解答。
(1)①由反应Fe+2Fe3+=3Fe2+可知,在反应中,Fe被氧化,失电子,应为原电池的负极,Fe3+在正极上得电子被还原,C为正极,负极电解液X中应含有亚铁离子,正极反应为:Fe3++e-=Fe2+,因而Y为含Fe3+的电解质溶液,所以电解质X为:FeCl2(或FeSO4),电解质Y为:FeCl3[或Fe2(SO4)3];
②负极:Fe被氧化,失电子,电极反应为:Fe-2e-=Fe2+,Fe3+在正极上得电子被还原,电极反应为:2Fe3++2e-=2Fe2+;
③外电路电子由负极流向正极,所以外电路中电子是从铁电极流向碳电极;
④Fe是负极,因而向X中迁移的是阴离子,即为NO3,故答案选B;
(2)由氧化还原反应2Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知,Cu发生氧化反应,作负极,其电极反应式为Cu-2e-=Cu2+,则负极的电解质为Cu(NO3)2,正极应选用碳棒或其他惰性电极,其电极反应式为:2NO3+6e-+8H+=2NO↑+4H2O,则正极的电解质为稀HNO3,则该装置图为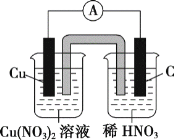 。
。


科目:高中化学 来源: 题型:
【题目】由A和B两种可溶性盐组成的混合物,进行了下列实验:
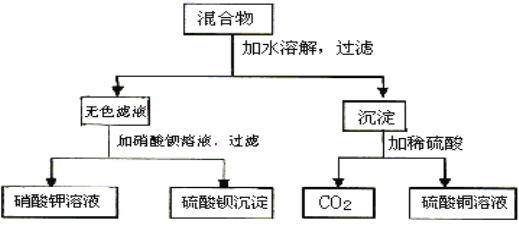
(1)若A溶液有颜色,试判断,A、B分别是_____________、_____________。(写化学式)
(2)写出实验过程中发生反应的离子方程式_____________、_____________、_____________。(顺序不限)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
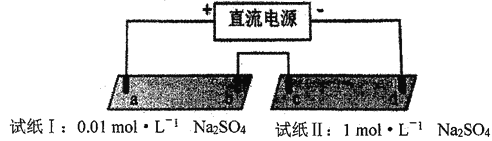
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。

已知:R1—CH===CH—R2![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
(1)③的反应条件是_________________________________________________。
(2)A的名称是_______________________________________________。
(3)有机物B和I的关系为________(填字母)。
A.同系物 B.同分异构体
C.都属于醇类 D.都属于烃
(4)①~⑩中属于取代反应的________________________________________。
(5)写出反应⑩的化学方程式____________________________________。
(6)写出两种D的属于酯类的链状同分异构体的结构简式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为![]() ,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
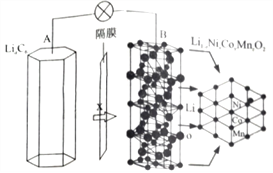
A. 允许离子X通过的隔膜属于阴离子交换膜
B. 充电时,A 为阴极,Li+被氧化
C. 可从无法充电的废旧电池的石墨电极中回收金属锂
D. 放电时,正极反应式为 Li1-aNixCoyMnzO2+aLi ++ae-= LiNixCoyMnzO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )
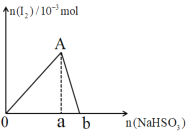
A.A点对应的I2的物质的量为1.0×10-3mol
B.0a:ab=5:1
C.当溶液中的n(I2)=5×10-4mol时,加入NaHSO3的物质的量可能为2.5×10-3mol或4.5×10-3mol
D.由ab段反应可知,氧化性I2>HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。如图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。

(1)上述流程中,为加快化学反应速率而采取的措施是_____。
(2)过程Ⅰ中,过氧化氢在酸性条件下将Cu溶解,该反应的离子方程式是_____。
(3)过程Ⅱ中加入过量铁粉的目的是_____,该过程中用到的分离操作是_____。
(4)过程Ⅲ中,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于___区,单质X的晶体类型为_____,其中X原子的配位数为_____。
(2)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是__________。
(3)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)X与Y形成的一种化合物的立方晶胞如图所示。
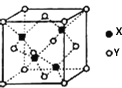
该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com