
【题目】向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )
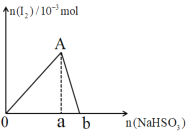
A.A点对应的I2的物质的量为1.0×10-3mol
B.0a:ab=5:1
C.当溶液中的n(I2)=5×10-4mol时,加入NaHSO3的物质的量可能为2.5×10-3mol或4.5×10-3mol
D.由ab段反应可知,氧化性I2>HSO3-
【答案】C
【解析】
加入NaHSO3的物质的量在0→a,发生的反应为:2IO3-+5HSO3-=5SO42-+I2+H2O+3H+,加入NaHSO3的物质的量在a→b,发生的反应为:I2+HSO3-+H2O=I-+SO42-+3H+。
A.A点时,10mL0.2mol·L-1的KIO3溶液中的KIO3恰好完全被亚硫酸氢钠还原为I2,由原子守恒可知,n(I2)=![]() n(KIO3)=
n(KIO3)=![]() ×0.2×10×10-3=1.0×10-3mol,A正确;
×0.2×10×10-3=1.0×10-3mol,A正确;
B.2IO3-+5HSO3-=5SO42-+I2+H2O+3H+,由离子方程式可知,0a消耗的亚硫酸氢钠的物质的量为:2.5×0.2×10×10-3=5.0×10-3mol;加入NaHSO3的物质的量在a→b,发生的反应为:I2+HSO3-+H2O=I-+SO42-+3H+,故ab消耗的亚硫酸氢钠的物质的量恰好与1.0×10-3molI2完全反应,所以ab消耗的亚硫酸氢钠的物质的量1.0×10-3mol,0a:ab=(5.0×10-3mol):(1.0×10-3mol)=5:1,B正确;
C.当溶液中的n(I2)=5×10-4mol时,n(I2)=5×10-4mol<1.0×10-3mol,故有两种情况,一种情况是在0→a,向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,刚好生成n(I2)=5×10-4mol,由2IO3-+5HSO3-=5SO42-+I2+H2O+3H+反应方程式可知,此时消耗亚硫酸氢钠的物质的量为:5×5×10-4mol=2.5×10-3mol;另一种情况是当10mL0.2mol·L-1的KIO3溶液中的KIO3恰好完全被亚硫酸氢钠还原为I2,有一部分的I2被亚硫酸氢钠还原为I-,消耗的亚硫酸氢钠的物质的量为5.0×10-3mol+5×10-4mol=5.5×10-3mol,C错误;
D.ab段发生的反应为I2+HSO3-+H2O=I-+SO42-+3H+,氧化性I2>HSO3-,D正确;
答案选C。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ由白色和黑色固体组成的混合物A,可以发生如下框图所示的一系列变化:
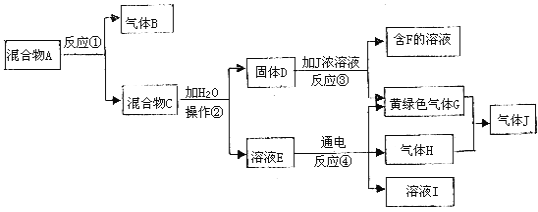
(1)写出反应③的化学方程式:_____________________________________________。写出反应④的离子方程式:_____________________________________________。
(2)在操作②中所使用的玻璃仪器的名称是:____________________________。
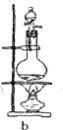
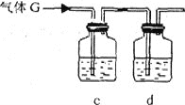
(3)下列实验装置中可用于实验室制取气体G的发生装置是______;(用字母表示)为了得到纯净干燥的气体G,可将气体通过c和d装置,c装置中存放的试剂_____,d装置中存放的试剂______。

(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出实验室利用烧碱溶液吸收气体G的离子方程式:____________________________。
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e~i装置中,可用于吸收J的是____________。
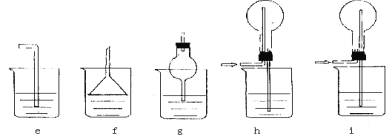
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。

(1)装置③中发生反应的化学方程式为________________________________________
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。
反应原理为3ClO-+I-===3Cl-+IO3- IO3-+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。该漂白粉中有效成分的质量分数为________________。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
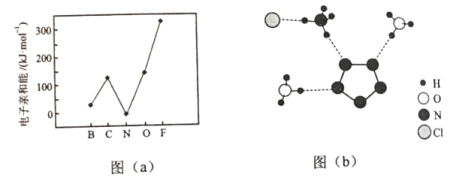
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5—中的大π键应表示为____________。
),则N5—中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)NH…Cl、____________、____________。
(4)R的晶体密度为d g·cm3,其立方晶胞参数为a nm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)理论上任何一个自发的氧化还原反应均可以设计成原电池。根据氧化还原反应Fe+2Fe3+=3Fe2+设计的原电池如图所示,其中盐桥内装琼脂饱和KNO3溶液。
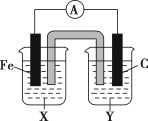
请回答下列问题:
①电解质溶液X是___;电解质溶液Y是___。
②写出两电极的电极反应式:铁电极:_;碳电极:__。
③外电路中的电子是从__电极流向__电极。(填“铁”或“碳”)
④盐桥中向X溶液中迁移的离子是__(填字母):A.K+ B.NO3-
(2)请将下列氧化还原反应3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O设计成原电池,画出(1)中的装置图,并写出相应的电极反应式。
①原电池装置图:_______;
②正极:_________;
③负极:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。下列各图均能表示甲烷的分子结构,按要求回答下列问题。
A.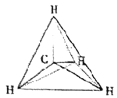 B.
B. C.
C. D.
D.
(1)甲烷的球棍模型是____________
(2)甲烷与丙烷互为____________
A.同位素 B.同素异形体 C.同系物 D.同分异构体。
(3)某研究小组为了探究甲烷和氯气反应的情况,设计了以下实验。
[实验一]用如图所示装置,试管中是甲烷和氯气的混合气体,光照后观察实验现象,回答以下问题。

①该反应的反应类型为_________。
②该反应的化学方程式为(只写第一步)_________。
③该实验的实验现象为____________、____________、试管壁上出现油状液滴。
④若题目中甲烷与氯气体积之比为1∶1,则得到的产物为____________(填字母,下同)。
A.![]() 、
、![]()
B.![]() 、
、![]()
C.![]() 、
、![]()
D.![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
[实验二]实验一光照一段时间后,往水槽中滴加![]() 溶液,看到有白色沉淀生成,认为甲烷与氯气反应有氯化氢生成。
溶液,看到有白色沉淀生成,认为甲烷与氯气反应有氯化氢生成。
⑤你认为该实验设计得出的结论是否正确?若不正确,回答理由_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过计算回答下列问题:
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱溶液,实验结束后,称得浓硫酸质量增加9g,浓碱溶液质量增加17.6g。该烃的化学式为_____,并写出其所有可能的结构简式:____。
(2)某链状烷烃的相对分子质量为128,该烷烃的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.用醋酸除去水垢:CaCO3 +2H+ = Ca2+ + CO2↑+ H2O
B.向AlCl3溶液中加入过量的浓氨水:Al3++4NH3H2O→AlO2-+4NH4++2H2O
C.向苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +CO32-
+CO32-
D.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-→BaCO3↓+NH3H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量不可能为8.8 g
B.被还原的硝酸的物质的量为0.4 mol
C.沉淀完全时消耗NaOH溶液的体积为150 mL
D.溶解合金时收集到NO气体的体积在标准状况下约为2.24 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com