
【题目】下列反应的离子方程式正确的是
A.用醋酸除去水垢:CaCO3 +2H+ = Ca2+ + CO2↑+ H2O
B.向AlCl3溶液中加入过量的浓氨水:Al3++4NH3H2O→AlO2-+4NH4++2H2O
C.向苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +CO32-
+CO32-
D.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-→BaCO3↓+NH3H2O+H2O
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3 和 AlCl3的混合溶液中逐滴加入1 mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
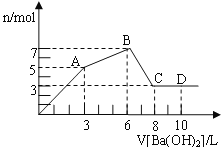
A.图中A点生成的沉淀是BaSO4和Al(OH)3
B.原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
C.AB段反应的离子方程式为:3Ba3++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
D.向D点溶液中通入CO2气体,立即产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )
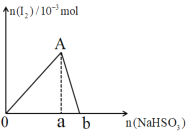
A.A点对应的I2的物质的量为1.0×10-3mol
B.0a:ab=5:1
C.当溶液中的n(I2)=5×10-4mol时,加入NaHSO3的物质的量可能为2.5×10-3mol或4.5×10-3mol
D.由ab段反应可知,氧化性I2>HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和五氧化二钒在工业应用中广泛,某工厂从钒渣中回收金属,钒渣中主要成分有V2O3、FeO,还含有少量的CuO、Al2O3,工艺流程如图:
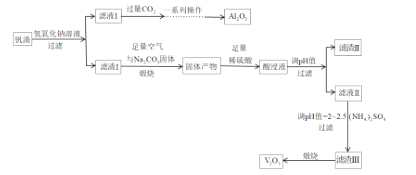
已知:①KspCu(OH)2=1.0×1021;KspFe(OH)3=4.0×1038;KspFe(OH)2=8.0×1016。
②NH4VO3难溶于水,(VO2)2SO4易溶于水。
(1)写出滤液I中加入过量的CO2时发生反应的离子方程式;制取纯净的Al2O3需要经过一系列操作:过滤、___、___。
(2)煅烧时,滤渣I的主要成分V2O3转化为可溶性NaVO3,写出其反应的化学方程式___。
(3)加入稀硫酸后,酸浸液中VO3与VO2+能大量共存的原因是___(用离子方程式解释)。
(4)常温下调节酸浸液的pH=___,即可以完全除去铁、铜两种元素对应的离子___;实际pH值要调整到8,其目的是___;调pH=2~2.5后过滤,滤渣III的主要成分为___。
(5)请写出煅烧滤渣III时,发生反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。如图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。

(1)上述流程中,为加快化学反应速率而采取的措施是_____。
(2)过程Ⅰ中,过氧化氢在酸性条件下将Cu溶解,该反应的离子方程式是_____。
(3)过程Ⅱ中加入过量铁粉的目的是_____,该过程中用到的分离操作是_____。
(4)过程Ⅲ中,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[![]() ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时,![]() 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是
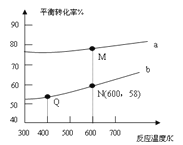
A.曲线b所对应的投料比为3:1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Zn片是_____ (填“正极”或“负极”),Cu片上发生的电极反应为_____。

(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是_____。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:
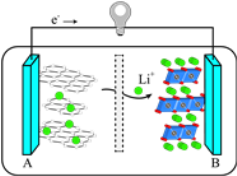
下列说法不正确的是_____(填序号)。
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:
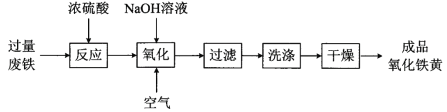
(1)氧化铁黄中铁元素的化合价为_____,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是______ (写离子方程式)。
(2)氧化过程生成氧化铁黄的化学方程式是_____________。
(3)上述流程中,检验“洗涤”是否完全的方法是________。
(4)氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,采用“亚硝酸甲酯-水合肼法”制备叠氮化钠的生产流程如下:
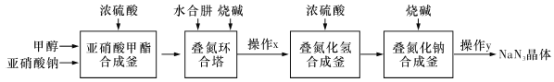
回答下列问题:
(1)亚硝酸甲酯合成釜中生成的亚硝酸甲酯(CH3ONO)易转化为气态进入叠氮环合塔,写出生成CH3ONO的化学反应方程式:_________________________________________________。
(2)叠氮环合塔中生成叠氮化钠的过程中生成一可循环使用的有机物,其官能团电子式为___________,该合成过程的化学方程式为______________________________________。
(3)已知氨基、氨气因有孤对电子而呈现一定碱性,所以水合肼(N2H4·H2O)的性质类似一水合氨,将硫酸与水合肼反应可以生成酸式盐,该盐的化学式为___________;叠氮环合塔中滴加的烧碱溶液要适当过量,目的主要是_________________________________。
A.促进NaN3水解 B抑制NaN3水解 C.作催化剂且对NaN3水解无影响
(4)生产中有HN3生成,请设计实验证明HN3为弱酸:________________________________。
(5)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理13 g NaN3,理论上需加入0.5 mol·L-1的NaClO溶液___________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com