
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量不可能为8.8 g
B.被还原的硝酸的物质的量为0.4 mol
C.沉淀完全时消耗NaOH溶液的体积为150 mL
D.溶解合金时收集到NO气体的体积在标准状况下约为2.24 L
【答案】D
【解析】
将镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol·L-1 NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为:n(OH-)=![]() =0.3mol,根据反应方程式可知,镁和铜的总的物质的量为:n=
=0.3mol,根据反应方程式可知,镁和铜的总的物质的量为:n=![]() ×n(OH-)=0.15mol。
×n(OH-)=0.15mol。
A.根据反应方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,镁和铜的总的物质的量为铜离子物质的量的一半,即:![]() =0.15mol,假定全为镁,金属质量为0.15mol×24g·mol-1=3.6g,若全为铜,金属质量为:0.15mol×64g·mol-1=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量可能为8.8g,故A错误;
=0.15mol,假定全为镁,金属质量为0.15mol×24g·mol-1=3.6g,若全为铜,金属质量为:0.15mol×64g·mol-1=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量可能为8.8g,故A错误;
B.n还原(HNO3)=![]() n(金属)=
n(金属)=![]() ×0.15mol=0.1mol,故B错误;
×0.15mol=0.1mol,故B错误;
C.反应消耗氢氧化钠的物质的量为:n(NaOH)=n(OH-)=0.3mol,则加入的氢氧化钠溶液的体积为:V=![]() =0.1L=100mL,故C错误;
=0.1L=100mL,故C错误;
D.金属的物质的量为0.15mol,完全反应失去0.15mol×2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量为:n(NO)=![]() =0.1mol,标准状况下0.1molNO的体积为2.24L,故D正确;
=0.1mol,标准状况下0.1molNO的体积为2.24L,故D正确;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )
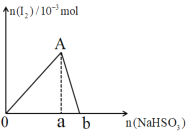
A.A点对应的I2的物质的量为1.0×10-3mol
B.0a:ab=5:1
C.当溶液中的n(I2)=5×10-4mol时,加入NaHSO3的物质的量可能为2.5×10-3mol或4.5×10-3mol
D.由ab段反应可知,氧化性I2>HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Zn片是_____ (填“正极”或“负极”),Cu片上发生的电极反应为_____。

(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是_____。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:
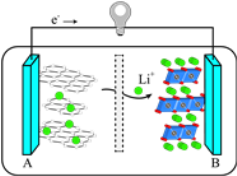
下列说法不正确的是_____(填序号)。
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:
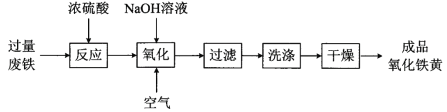
(1)氧化铁黄中铁元素的化合价为_____,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是______ (写离子方程式)。
(2)氧化过程生成氧化铁黄的化学方程式是_____________。
(3)上述流程中,检验“洗涤”是否完全的方法是________。
(4)氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于___区,单质X的晶体类型为_____,其中X原子的配位数为_____。
(2)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是__________。
(3)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)X与Y形成的一种化合物的立方晶胞如图所示。
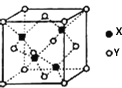
该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),该反应温度越高,反应物转化率越低,673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
2NH3(g),该反应温度越高,反应物转化率越低,673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是( )
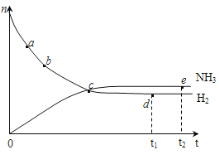
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
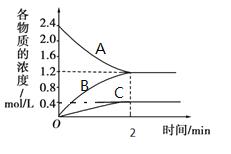
(1)该反应的化学方程式为__。
(2)从开始至2min,B的平均反应速率为__。
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号)__。
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3nmolA,同时消耗nmol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是___。
A.加催化剂
B.降低温度
C.体积不变,充入A
D.体积不变,从容器中分离出A
(5)改变影响平衡的一个条件,5分钟后又建立了新平衡,发现C占平衡混合气的体积分数为![]() ,则反应物A的分解率为___。
,则反应物A的分解率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,采用“亚硝酸甲酯-水合肼法”制备叠氮化钠的生产流程如下:
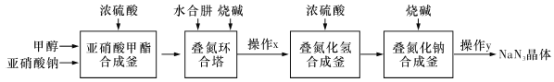
回答下列问题:
(1)亚硝酸甲酯合成釜中生成的亚硝酸甲酯(CH3ONO)易转化为气态进入叠氮环合塔,写出生成CH3ONO的化学反应方程式:_________________________________________________。
(2)叠氮环合塔中生成叠氮化钠的过程中生成一可循环使用的有机物,其官能团电子式为___________,该合成过程的化学方程式为______________________________________。
(3)已知氨基、氨气因有孤对电子而呈现一定碱性,所以水合肼(N2H4·H2O)的性质类似一水合氨,将硫酸与水合肼反应可以生成酸式盐,该盐的化学式为___________;叠氮环合塔中滴加的烧碱溶液要适当过量,目的主要是_________________________________。
A.促进NaN3水解 B抑制NaN3水解 C.作催化剂且对NaN3水解无影响
(4)生产中有HN3生成,请设计实验证明HN3为弱酸:________________________________。
(5)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理13 g NaN3,理论上需加入0.5 mol·L-1的NaClO溶液___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质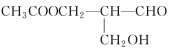 有光学活性,发生下列反应后生成的有机物无光学活性的是
有光学活性,发生下列反应后生成的有机物无光学活性的是
①与甲酸发生酯化反应 ②与银氨溶液作用 ③与NaOH溶液反应 ④在催化剂存在下与氢气作用
A. ①③B. ②④C. ③④D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com