
【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

【答案】B
【解析】
A. 节日里燃放的五彩缤纷的烟花是某些金属元素发生焰色反应体现的,焰色反应是物理变化,不是化学性质的展现,A错误;
B. 设物质的量都为1mol,则
Na2O+H2O=2NaOH △m
1mol 2mol 62g
2Na2O2+2H2O=4NaOH+O2↑ △m
1mol 2mol 62g
由方程式可知,生成溶质的物质的量相等,则溶质的质量相等,反应后两溶液的质量相等,则两溶液溶质质量分数相等,B正确;
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,由于铝易被氧化为氧化铝,且氧化铝的熔点高,因此熔化后的液态铝不会滴落下来,C错误;
D. 氢氧化铝是两性氢氧化物,将装置①中的AlCl3溶液滴入装置②浓氢氧化钠溶液中,开始氢氧化钠过量,溶液中不会产生氢氧化铝沉淀,因此不可能观察到有大量白色沉淀产生,D错误。
答案选B。


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数。下列说法正确的是
A. 适量Na2O2溶于水充分反应,生成0.1mol O2,则电子转移数目为0.4NA
B. 1mol氨基(-NH2)中含有电子的数目为9NA
C. 42g有机物C3H6中含有双键数目为NA
D. 1mol/L的NaClO溶液中含有ClO-的数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时有氢气生成。反应中,每生成3molH2时放出30.8kJ的热量。恒温恒容密闭体系内进行上述反应, 下列有关表达正确的是
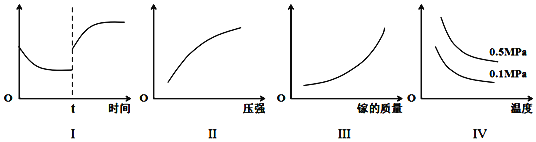
A. I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B. II图像中纵坐标可以为镓的转化率
C. III图像中纵坐标可以为化学反应速率
D. IV图像中纵坐标可以为体系内混合气体平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,B常温下为无色液体,Fe遇浓的G溶液钝化。

(1)写出下列各物质的化学式:
B:____________;F:____________;G:___________。
(2)写出下列变化的反应方程式:
A→D:________________________________________;
G→E:________________________________________。
(3)实验室里,常用加热_____________________的混合物的方法制取气体C,常采用____________法来收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按右下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )

A. C1上发生还原反应
B. M 装置中SO42-移向Cu电极
C. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
D. Cu电极与C2电极上的电极反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:

步骤1:在三颈烧瓶中加入一定量Na2S03和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHS03溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是____:冷凝管中冷却水从____(填“a”,或“b”)口进水。
(2)A中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除H20外还有____(填化学式)。
(4)步骤3中在真空容器中蒸发浓缩的原因是____。
(5)为测定产品的纯度,准确称取2.Og样品,完全溶于水配成l00mL溶液,取20.00mL所配溶液,加过量碘完全反应后(己知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)试写出实验b发生反应的离子方程式 。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围? 。
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100 mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O/span>;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。(写出具体计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①Cu丝 ②Cl2 ③Al2(SO4)3溶液 ④蔗糖 ⑤浓硝酸⑥Ca(OH)2⑦NH4Cl⑧CO2 ⑨氨水
请用以上相应的数字编号和化学用语回答问题:
(1)属于电解质的是__________;属于非电解质的是__________.
(2)实验室制取氨气的化学反应方程式_______________________.
(3)工业制漂白粉的化学反应方程式__________________________.
(4)实验室制Al(OH)3的离子方程式______________________________________________________
(5)①和⑤的化学方程式并用双线桥标出电子转移__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com