
����Ŀ�����������Ƽ�ȩ(NaHSO2��HCHO��2H2O)�׳Ƶ��飬���ȶ���120��ʱ��ֽ⡣��ӡȾ��ҽҩ�Լ�ԭ���ܹ�ҵ���й㷺Ӧ�á���Na2SO3��SO2��HCHO��п��Ϊԭ���Ʊ����������Ƽ�ȩ��ʵ�鲽�����£�

����1����������ƿ�м���һ����Na2S03��ˮ�������ܽ⣬����ͨ��SO2������ҺpHԼΪ4���Ƶ�NaHS03��Һ��
����2����װ��A�е����ܻ�����Ƥ��������ƿ�м����Թ�����п�ۺ�һ������ȩ��Һ����80��90���£���ӦԼ3h����ȴ�����£����ˣ�
����3������Һ�������Ũ������ȴ�ᾧ��
(1)װ��B���ձ���Ӧ�������Һ��____������������ȴˮ��____���a������b�����ڽ�ˮ��
(2)A�ж�����ݵ�������________��
(3)�������л�������Ҫ���ʳ�H20���____���ѧʽ����
(4)����3�����������������Ũ����ԭ����____��
(5)Ϊ�ⶨ��Ʒ�Ĵ��ȣ�ȷ��ȡ2.Og��Ʒ����ȫ����ˮ���l00mL��Һ��ȡ20.00mL������Һ���ӹ�������ȫ��Ӧ��֪I2����������ȩ�����ʲ���Ӧ��������BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������صõ���ɫ����0.466g����Ʒ�Ĵ���Ϊ____��
���𰸡�NaOH��Һa������������Һ�ĽӴ�������ӿ��������������HCHO��ֹ�¶ȹ���ʹ����ֽ⣬Ҳ��ֹ��������������77%
��������
��1����ʵ������Na2SO3��SO2��HCHO��п��Ϊԭ���Ʊ����������Ƽ�ȩ��SO2��Ϊβ�������ŷŵ������У�װ��B������������SO2������װ��B���ձ���Ӧ�������Һ��NaOH��Һ������ˮ���¿ڽ�ˮ������������ˮ���������д��ڣ�����Ч�����ã�������ȴˮ��a�ڽ�ˮ��
��2��������ݵı���������A�з����˶�����ݵ�Ŀ����Ϊ��������������Һ�ĽӴ�������ӿ�������������ʡ�
��3��HCHO���лӷ��ԣ���80�桫90�������»�����ӷ����������ܿ���ʹHCHO�����������HCHO�������ʣ����������л�������Ҫ���ʳ�H20���HCHO��
��4�����������Ƽ�ȩ���л�ԭ�ԣ��ڳ�������������Ũ�����ɱ������е������������ʣ���˲���3�����������������Ũ����ԭ����Ϊ�˷�ֹ�¶ȹ���ʹ����ֽ⣬ͬʱҲ��ֹ����������������
��6���������ⷢ�������ӷ�ӦΪ2H2O+HSO2-+2I2��SO42-+4I��+5H����SO42-+Ba2����BaSO4������˵ù�ϵʽΪ
NaHSO2HCHO2H2O����BaSO4
154 233
x 0.466g
���x��0.308g
�����ò�Ʒ�Ĵ���Ϊ![]() ��77%��
��77%��


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100mol��L-1��NaOH��Һ�ֱ�ζ���Ϊ20.00mL0.100mol��L-1��HCl��Һ�ʹ�����Һ���ζ�������ͼ��ʾ������˵����ȷ����

A. I��ʾ���ǵζ����������
B. pH =7ʱ���ζ��������ĵ�V(NaOH)��20.00mL
C. V(NaOH)= 20.00mLʱ��������Һ��c(Cl-)��c(CH3COO-)
D. V(NaOH)=10.00mLʱ��������c(Na+)��c(CH3COO-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����Ԫ����H2X��Һ�к�X���ķֲ�������ͼ��ʾ������������ȷ����
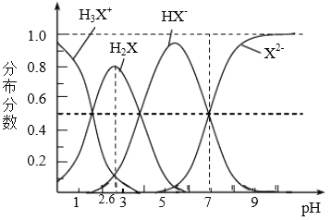
A. ��ҺpH��l����2.6ʱ��Ҫ���ڵķ�Ӧ�ǣ�H3X++OH-��H2X+H20
B. H2X�ĵڶ�������ƽ�ⳣ��Ka2(H2X)Ϊ10-4
C. NaHX��Һ��c(H+)��c(OH-)
D. ����Һ������ʱ��c(Na+)��2c(X2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ������ȼ�ŵ�����ͷ��̻���ijЩ����Ԫ�ػ�ѧ���ʵ�չ��
B. �������ʵ����������ƺ������Ʒֱ�Ͷ�뵽�����ҵ�������ˮ�У��õ��������������ֱ��� a%�� b%��������Һ����a �� b �Ĺ�ϵ�� a=b
C. ������ǯ��סһС����ɰֽ��ϸ��ĥ���������ھƾ����ϼ��ȣ��ۻ����Һ̬������������ ˵�����������۵�ϵ�
D. ����ͼװ�ý���ʵ�飬��װ�����е� AlCl3 ��Һ����װ����Ũ����������Һ����Һ�пɹ۲쵽�д�����ɫ��������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000mol/L��NaOH��Һ�ζ�20mLͬŨ�ȵ�һԪ����HA���ζ�������ҺpH��NaOH��Һ������ı仯������ͼ��ʾ�������к���ЧӦ��������˵������ȷ����

A. �����£�HA�ĵ��볣��K(HA)ԼΪ10-5
B. v1<20
C. ��Һ��ˮ�ĵ���̶ȣ�a��>b��
D. �ζ�����Ϊ��ȷ���ζ��յ㣬����ʵ�ָʾ���Ƿ�̪
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״����V L�����ܽ���1 Lˮ��(ˮ���ܶȽ���Ϊ1 g��mL��1)��������Һ���ܶ�Ϊ�� g��mL��1����������Ϊw�����ʵ���Ũ��Ϊc mol��L��1�������й�ϵ�в���ȷ����
A. ����![]() B. w��
B. w��![]()
C. w��![]() D. c��
D. c��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��25��ʱ��0.1 mol L-1 HCl��Һ����Kw=__________________��c(Cl-)=____________��c(OH-)=______________�� pH=_______��
��2��25��ʱ����������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ�����Һ��______��������������������������������������Һ��c(Na+ ) ______c(CH3COO��)������ >��������������<�� ����
��3��25��ʱ, pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ��__________��������������������������������������Һ��c(Na+ ) ______c(CH3COO��) ������ >�� ������������<�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ������Na2CO3��NaHCO3�������������������ų�Ϊֹ���Ƶü��Ⱥ�ʣ�����������ԭ��������6.2 g������ȡͬ��������ԭ������������������ᷴӦ������15.68 L CO2(��״��)������㣺
(1)���Ⱥ�ʣ��������ʵijɷ���ʲô_________��
(2)�������Na2CO3��NaHCO3�����ʵ����ֱ��Ƕ���______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ�ǰ��������ԭ�������������������Ԫ��A��B��C��D��E��F�У�A����������Ԫ�ؼȲ�ͬ����Ҳ��ͬ���壬B��һ�ֺ����ڿ���ʱ����������һЩ����������C���������ǵ����������Ҫ����֮һ��Dԭ�Ӻ��������8�ֲ�ͬ���˶�״̬��E�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������࣬FԪ�صĻ�̬ԭ�������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӣ�
��1��д����̬Eԭ�ӵļ۵����Ų�ʽ ��
��2��B��C��D��Ԫ�ص�һ��������С�����˳��Ϊ����Ԫ�ط��ű� ʾ�� ��A��C�γ�CA3�ͷ��ӣ�������Cԭ�ӵ��ӻ�����Ϊ �����ӵ�����ṹΪ ��C�ĵ����� BD�������ǵȵ����壬�ݵȵ������ԭ����д��BD������ĵ���ʽ �� A2D��Һ̬�γɾ���ʱ�ܶ� ������������С����������Ҫԭ��������������
��3����֪D��F���γ�һ�ֻ�����侧���Ľṹ��ͼ��ʾ����û�����Ļ�ѧʽΪ����Ԫ�ط��ű�ʾ�� ��������Dԭ�Ӻ�Fԭ�Ӽ�ľ���Ϊa cm������٤������ΪNA����þ�����ܶ�Ϊ g/cm3���ú�a��NA�ķ��ű�ʾ����

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com