
【题目】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是

A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】C
【解析】A. 0.100mol·L-1的HCl溶液和醋酸溶液,醋酸难电离,所以起点pH较小 的I表示的是滴定盐酸的曲线,故A错误;B. 当醋酸与氢氧化钠恰好完全反应时,形成醋酸钠溶液,醋酸钠水解使溶液pH>7,所以pH =7时,滴定醋酸消耗的V(NaOH)<20.00mL,故B错误;C. V(NaOH)= 20.00mL时,酸碱恰好完全反应,因为CH3COO-水解而消耗,所以两份溶液中c(Cl-)>c(CH3COO-),故C正确;D. V(NaOH)=10.00mL时,生成的醋酸钠与剩余醋酸浓度相等,由于醋酸的电离程度大于醋酸钠的水解程度,所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误。故选C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
B.配合物中,中心离子与配体间、配离子与酸根离子间都是以配位键结合
C.配离子中,中心离子提供空轨道,配体提供孤对电子对
D.NH4+是平面四边形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag。其工作示意图如图所示。下列说法不正确的是( )
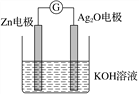
A. Zn电极是负极
B. Ag2O电极发生还原反应
C. Zn电极的电极反应式:Zn-2e-+2OH-===Zn(OH)2
D. 放电前后电解质溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)俗称双氧水。是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业。回答下列问题:
(1) H2O2的电子式为_______________。
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜。
已知:Cu(s)+2H+ (aq)==Cu2+(aq) + H2(g) H= +64 kJ/mol
2H2O2(1) ==2H2O(l)+O2(g) H =-196 kJmol
H2(g) + l/2O2(g) ==H2O(l) H =-286 kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:__________________。
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4![]() (NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
(NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
①电解时阳极的电极反应式为___________________;
②(NH4)2 S2O8水解时发生反应的化学方程式为 ____________________。
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验I | 25℃ | 三氧化二铁 | 10mL 5% H2O2 |
甲组实验II | 25℃ | 二氧化锰 | 10 mL 5% H2O2 |
甲、乙两小组得出如下图数据。
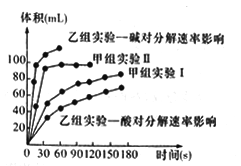
①甲小组实验得出的结论是______________________。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为_______________;支持这一方案的理由是_______________________。
③已知过氧化氢还是一种极弱的二元酸:H2O2![]() H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-![]() HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是
A.该溶液可能pH=5B.该溶液的pH一定是9
C.该溶液的pH可能是7D.不会有这样的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
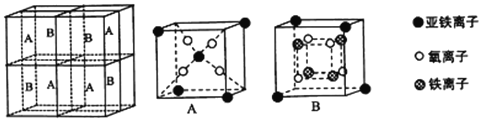
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )

A. 该反应的逆反应是放热反应
B. 该反应在T1、T3温度时达到化学平衡
C. 该反应在T2温度时达到化学平衡
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com