
【题目】取一定量的Na2CO3和NaHCO3固体混合物加热至无气体放出为止,称得加热后剩余固体质量比原来减少了6.2 g,现再取同样质量的原固体混合物与过量的盐酸反应,生成15.68 L CO2(标准状况)。请计算:
(1)加热后剩余固体物质的成分是什么_________?
(2)混合物中Na2CO3和NaHCO3的物质的量分别是多少______________?
【答案】Na2CO3 0.5mol 0.2mol
【解析】
(1)因Na2CO3的热稳定性好,所以Na2CO3和NaHCO3固体混合物加热至无气体放出为止,只发生2NaHCO![]() Na2CO3+H2O+CO2
Na2CO3+H2O+CO2![]() ,剩余固体质量包括加热分解生成的Na2CO3及原混合物中含有的Na2CO3,因此,本题答案是: Na2CO3;
,剩余固体质量包括加热分解生成的Na2CO3及原混合物中含有的Na2CO3,因此,本题答案是: Na2CO3;
(2)6.2克为生成的二氧化碳气体和水,令碳酸氢钠的质量为a,则:
2NaHCO3![]() Na2CO3+H2O+CO2
Na2CO3+H2O+CO2![]() 质量减少
质量减少
168 62
a 6.2g
所以168:62=a:6.2g,计算得出a=16.8g,故n(NaHCO3)=m/M=16.8g/84g![]() mol-1=0.2mol,混合物与盐酸反应生成的二氧化碳的物质的量n=V/Vm=15.68L/22.4L
mol-1=0.2mol,混合物与盐酸反应生成的二氧化碳的物质的量n=V/Vm=15.68L/22.4L![]() mol-1=0.7mol;NaHCO3+HCl=NaCl+H2O+CO2
mol-1=0.7mol;NaHCO3+HCl=NaCl+H2O+CO2![]() ,Na2CO3+2HCl=2NaCl+H2O+CO2
,Na2CO3+2HCl=2NaCl+H2O+CO2![]() ,根据碳原子守恒可以知道n(NaHCO3)+ n(Na2CO3)=n(CO2)=0.7mol,故n(Na2CO3)=0.7mol-0.2mol=0.5mol, 所以混合物中Na2CO3和NaHCO3的物质的量分别是0.5mol、0.2mol。
,根据碳原子守恒可以知道n(NaHCO3)+ n(Na2CO3)=n(CO2)=0.7mol,故n(Na2CO3)=0.7mol-0.2mol=0.5mol, 所以混合物中Na2CO3和NaHCO3的物质的量分别是0.5mol、0.2mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时有氢气生成。反应中,每生成3molH2时放出30.8kJ的热量。恒温恒容密闭体系内进行上述反应, 下列有关表达正确的是
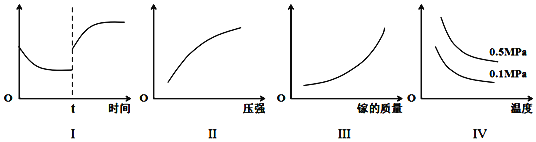
A. I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B. II图像中纵坐标可以为镓的转化率
C. III图像中纵坐标可以为化学反应速率
D. IV图像中纵坐标可以为体系内混合气体平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:

步骤1:在三颈烧瓶中加入一定量Na2S03和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHS03溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是____:冷凝管中冷却水从____(填“a”,或“b”)口进水。
(2)A中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除H20外还有____(填化学式)。
(4)步骤3中在真空容器中蒸发浓缩的原因是____。
(5)为测定产品的纯度,准确称取2.Og样品,完全溶于水配成l00mL溶液,取20.00mL所配溶液,加过量碘完全反应后(己知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)试写出实验b发生反应的离子方程式 。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围? 。
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100 mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O/span>;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。(写出具体计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是
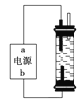
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,1mol N2和3mol H2混合后反应,达到平衡时测得混合气体的密度是同温同压下氢气的5倍,则氮气的转化率为( )
A. 20% B. 30% C. 40% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12 mL 0.1 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A. +2 B. +3 C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①Cu丝 ②Cl2 ③Al2(SO4)3溶液 ④蔗糖 ⑤浓硝酸⑥Ca(OH)2⑦NH4Cl⑧CO2 ⑨氨水
请用以上相应的数字编号和化学用语回答问题:
(1)属于电解质的是__________;属于非电解质的是__________.
(2)实验室制取氨气的化学反应方程式_______________________.
(3)工业制漂白粉的化学反应方程式__________________________.
(4)实验室制Al(OH)3的离子方程式______________________________________________________
(5)①和⑤的化学方程式并用双线桥标出电子转移__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是:__________。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:

①在该实验中,甲部分的装置是__________(填字母)。
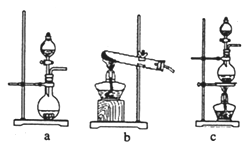
如何检查该装置的气密性?__________________________________________。
②乙装置中FeCl2溶液与Cl2:反应的离子方程式是_______________。
③丙装置中通人少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是____________。
④该实验存在明显的缺陷,改进的方法________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com