
【题目】NA为阿伏加德罗常数。下列说法正确的是
A. 适量Na2O2溶于水充分反应,生成0.1mol O2,则电子转移数目为0.4NA
B. 1mol氨基(-NH2)中含有电子的数目为9NA
C. 42g有机物C3H6中含有双键数目为NA
D. 1mol/L的NaClO溶液中含有ClO-的数目小于NA
【答案】B
【解析】
A.2Na2O2+2H2O=4NaOH+O2↑反应中,过氧化钠中的氧元素化合价从-1变化到-2和0价,根据电子守恒,生成0.1mol O2,转移0.2NA个电子;B.1个氨基(-NH2)中含电子9个;
C.有机物C3H6可能为烯烃也可能是环烷烃,若为环烷烃不含碳碳双键;D.没有给出溶液体积大小,无法计算NaClO的物质的量。
A项,2Na2O2+2H2O=4NaOH+O2↑反应中,过氧化钠中的氧元素化合价从-1变化到-2和0价,根据电子守恒,生成0.1mol O2,转移0.2NA个电子,故A错误;
B项,1个氨基(-NH2)中含电子9个,1mol氨基(-NH2)中含有电子的数目为9NA,故B正确;
C项,42g有机物 C3H6的物质的量为:![]() =1mol,若C3H6为烯烃,烯烃分子中含碳碳双键数目NA,C3H6也可以为环烷烃,故C错误;
=1mol,若C3H6为烯烃,烯烃分子中含碳碳双键数目NA,C3H6也可以为环烷烃,故C错误;
D.没有给出溶液体积大小,无法计算,故D错误。
综上所述,本题正确答案为B。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
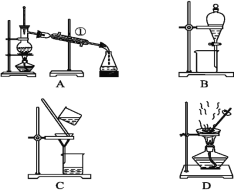
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中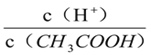 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不![]() 变
变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应:Fe2O3+2Al![]() Al2O3+2Fe。
Al2O3+2Fe。
(1)________元素的化合价升高,则该元素的原子________电子,被________(填“氧化”或“还原”);而________元素的化合价降低,则该元素的原子________电子,被________(填“氧化”或“还原”)。
(2)该反应中Fe2O3发生了________反应,Al发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图1为实验室制取氨的实验装置。

(1)写出A中所发生反应的化学方程式________________________。
(2)该装置还可以制备哪些气体________;试管口略向下倾斜的原因是__________。
(3)在收集氨气时,试管口一团棉花的作用是_________________________。
(4)一位学生用制得的氨,按上图2装置进行喷泉实验,烧瓶已充满干燥的氨气,引发喷泉实验的操作是_____________________________。
(5)另一学生积极思考产生喷泉的其他方法,设计上图3装置。
①首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是_____________。
A.碳酸钙粉末和浓盐酸
B.碳酸氢铵溶液与稀氢氧化钠溶液
C.氯化氢和硝酸银溶液
D.氯化氢和酚酞溶液
②该同学又向锥形瓶中加入酒精,水槽加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是____________。
A.硝酸铵 B.食盐 C.浓硫酸 D.硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)用托盘天平称取氯化钠固体,其质量为__________ g。
(3)下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学常用于混合物分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置____(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为__________。
(3)装置B在分液时为使液体顺利下滴,应进行的具体操作是__________________________
(4)海水中蕴藏着丰富的资源,取少量海水按如下流程进行实验:
海水![]() 粗盐
粗盐![]() 食盐水
食盐水![]() 氯化钠晶体
氯化钠晶体
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是____(填写字母序号)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是

A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
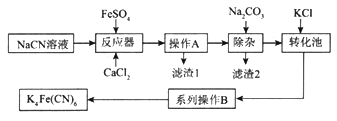
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。
(3)系列操作B为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
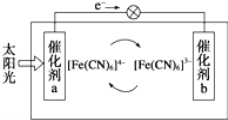
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com