
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.分析 (1)X的转化率是$\frac{X的变化量}{X的起始量}×100%$;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)根据c=$\frac{△c}{△t}$计算反应速率;
(4)当反应进行到2min时各物质的量不随时间的改变而改变,反应达平衡状态;
(5)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热并判断吸热还是放热.
解答 解:(1)X的转化率是$\frac{X的变化量}{X的起始量}×100%$=$\frac{1-0.7}{1}×100%$=30%,故答案为:30%;
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)反应开始至2min时Z的平均反应速率为:c(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
(4)当反应进行到2min时各物质的量不随时间的改变而改变,反应达平衡状态,故答案为:2;
(5)拆1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,
所以生成1mol NH3放出热量为46KJ;
故答案为:放出;46.
点评 本题考查化学方程式的判断以及反应速率的计算,题目难度不大,注意图象题目中曲线的变化特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯化铵和熟石灰制氨气:NH4++OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 铜与浓硫酸反应:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
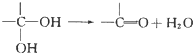
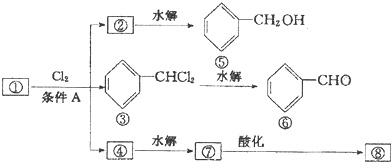
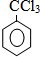 、
、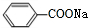 .
.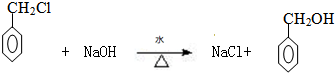 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
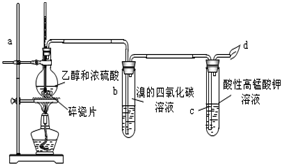
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H +数为2NA | |
| C. | 常温常压下,46g NO2和N2O4的混合气体含有的原子数是3NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属活动性A<B | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 在后者装置中金属B的表面有明显气泡产生,金属A表面无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定某草酸【H2C2O4】溶液的浓度,参考图,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定某草酸【H2C2O4】溶液的浓度,参考图,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 酚酞 | (乙) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (甲) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com