
| A. | 实验室用氯化铵和熟石灰制氨气:NH4++OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 铜与浓硫酸反应:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
分析 A.制备氨气时,固体氯化铵和氢氧化钙不能拆;
B.浓硫酸应保留化学式,且不符合反应客观事实;
C.发生氧化还原反应生成硫酸钙;
D.二者反应生成硝酸铜和一氧化氮、水;
解答 解:A.实验室用氯化铵和熟石灰制氨气,氯化铵、氢氧化钙为固体,应保留化学式,故A错误;
B.铜与浓硫酸反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O+SO42-,故B错误;
C.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++3ClO-+SO2+H2O=CaSO4↓+2HClO+Cl-,故C错误;
D.二者反应生成硝酸铜和一氧化氮、水,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D正确;
故选:D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子方程式书写考查,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用溴水鉴别直馏汽油和裂化汽油 | |
| B. | “乙醇汽油”是在汽油里加入适量乙醇而形成的一种燃料,它是一种新型化合物 | |
| C. | 煤的干馏和石油的分馏都是物理变化 | |
| D. | 石油分馏获得的石油气中,含甲烷、乙烷、乙烯等气态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
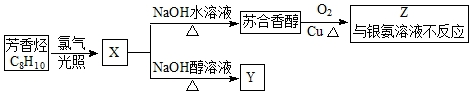
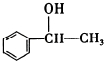 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
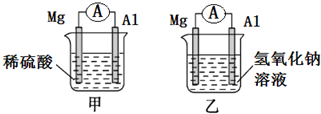 有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有共价键的数目为0.4 NA | |
| B. | 常温下,9.2 g NO2和N2O4的混合气体中含有氮原子的数目为0.2 NA | |
| C. | 电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2 NA | |
| D. | 0.1mol苯乙烯中含有碳碳双键的数目为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率和B的消耗速率相等 | |
| B. | 反应混合物中A、B、C、D的浓度不再发生变化 | |
| C. | 2v正(A)=v正(B) | |
| D. | v正(A)=2v正(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
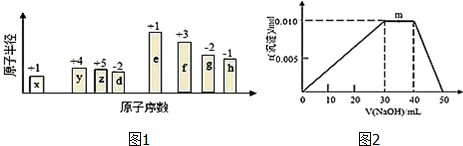

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用铝制槽罐车运输浓硫酸 | |
| B. | 亚硝酸盐可以防腐,所以在食品中可以广泛使用 | |
| C. | 洁厕灵和漂白粉都具有去污作用,一同使用效果会更好 | |
| D. | 治疗胃酸过多可以使用碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com