
【题目】下列说法正确的是 ( )
A. 乙烯和苯都可以使溴水褪色
B. 乙烯可以与氢气发生加成反应,苯不能与氢气加成
C. 甲烷和乙烯都可以与氯气反应
D. 液化石油气和天然气的主要成分都是甲烷
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.Al2(SO4)3
B.NaOH
C.BaCl2
D.FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H22NH3 , 在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03 mol/(Lmin)
B.v(N2)=0.02 mol/(Lmin)
C.v(NH3)=0.17 mol/(Lmin)
D.v(NH3)=0.01 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中常用铝制炊具,它质轻且坚固耐用,其中的原因是( )
A.铝很不活泼,不易与其他物质反应
B.铝虽然很活泼,但是只有在高温下才能与其他物质反应
C.铝制品表面有一层致密的氧化物薄膜,起保护作用
D.铝制品表面镀有一层铜,可以保护铝制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 蒸发操作时,应使混合物中的水分少量剩余时,才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:电池:Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)。电解池:2Al+3H2O![]() Al2O3+3H2↑,电解过程中,以下判断正确的是
Al2O3+3H2↑,电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb O2电极 | H+移向Pb电极 |
B | 每消耗3mol Pb | 生成2 mol Al2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+I2(g)![]() 2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
A. 容器体积不变,升温正、逆反应速率均增大
B. 温度、压强均不变,充入氦气,正、逆反应速率不变
C. 温度不变,压缩气体的体积,平衡不移动,颜色加深
D. 容积、温度不变,充入氦气后,正、逆反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应及其应用在化学中占有重要地位。回答下列各题。
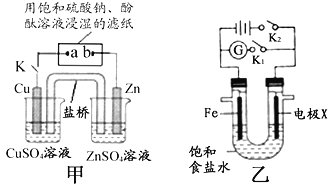
(1)写出铝与氢氧化钠溶液反应的离子方程式____________________;若将镁条、铝条和灵敏电流计用导线相连,使镁条、铝条浸入氢氧化钠溶液中,电流计指针发生偏转时,负极材料为________。
(2)当闭合K时,甲装置中Zn极的电极反应式为____;电子流动的方向为______;若盐桥中填充KCl琼脂,K+离子移动的方向为______;a极的电极反式为________;一段时间后,b极附近的现象为____________________。
(3)装置乙中。
①断开K2,接通K1。当X为石墨电极,Fe极的电极反应式为_________;当X为锌电极,Fe极的电极反应式为_____________。
②断开K1,接通K2。若X为石墨电极,X极的电极名称为_____;装置反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的化学方程式为____________________________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色 时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
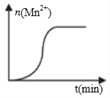
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com