
����Ŀ��ijʵ��С�����ʵ�飬��������KMnO4��Һ��H2C2O4��Һ��Ӧ���ⶨ��Һ��ɫ��ʧ����ʱ��ķ������о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣��ѡ���ʵ��ҩƷ�У�0.01mol��L��1����KMnO4��Һ��0.1mol��L��1����KMnO4��Һ��0.1mol��L��1H2C2O4��Һ��0.2mol��L��1H2C2O4��Һ��
��1��H2C2O4��Һ������KMnO4��Һ��Ӧ�Ļ�ѧ����ʽΪ____________________________��
��2�����������ʵ����Ʊ���
ʵ�� | ����KMnO4��Һ | H2C2O4��Һ | ��ɫ ʱ��/s | ||
c/(mol��L��1) | V/mL | c/(mol��L��1) | V/mL | ||
�� | 0.01 | 4 | 0.1 | 2 | t1 |
�� | a | 4 | b | 2 | t2 |
�ٱ���a=________��b=________��
�ڼ���ʵ��KMnO4��ƽ����Ӧ�����ǣ�____________���ú�t1��ʽ�ӱ�ʾ����
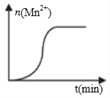
��3�����ij��ʵ�飨���£�ʱ����Һ��Mn2+���ʵ�����ʱ���ϵ��ͼ�������n(Mn2+)�ڷ�Ӧ��ʼʱ�仯����һ��ʱ�����������ԭ��______��
���𰸡� 5H2C2O4 +2KMnO4 +3H2SO4 �T K2SO4 +2MnSO4+10CO2��+8H2O 0.01 0.2 ![]() mol��L��1��s��1 Mn2+�Ը÷�Ӧ�д�����
mol��L��1��s��1 Mn2+�Ը÷�Ӧ�д�����
����������1�����ᣨH2C2O4����Һ������KMnO4��Һ����������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪMn2+����Ӧ�Ļ�ѧ����ʽΪ5H2C2O4 +2KMnO4 +3H2SO4 �T K2SO4 +2MnSO4+10CO2��+8H2O����2�����о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬����KMnO4��Һ��Ũ�Ȳ���̫�ߣ�KMnO4��ҺŨ��Խ����ɫԽ�����ԣ��ʼ�������Ũ��ȡ��ȣ�a=0.01����H2C2O4��ҺŨ�ȼ������鲻ͬ��b=0.2���ڼ���ʵ��KMnO4��ƽ����Ӧ������![]() =
=![]() mol��L��1��s��1����3��n(Mn2+)�ڷ�Ӧ��ʼʱ�仯��������Ҳ�仯����һ��ʱ�������n(Mn2+)���࣬��Ӧ���ʿ�����������ΪMn2+�Ը÷�Ӧ�д����á�
mol��L��1��s��1����3��n(Mn2+)�ڷ�Ӧ��ʼʱ�仯��������Ҳ�仯����һ��ʱ�������n(Mn2+)���࣬��Ӧ���ʿ�����������ΪMn2+�Ը÷�Ӧ�д����á�


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� �� ��
A. ��ϩ�ͱ�������ʹ��ˮ��ɫ
B. ��ϩ���������������ӳɷ�Ӧ���������������ӳ�
C. �������ϩ��������������Ӧ
D. Һ��ʯ��������Ȼ������Ҫ�ɷֶ��Ǽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84������Һ���ճ�������ʹ�ù㷺��������Һ��ɫ����Ư�����á�������Ч�ɷ������������е�һ�֣����������ǣ� ��
A. NaOHB. NaClOC. KMnO4D. Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����X������Yͬʱͨ�� ʢ����ҺZ��ϴ��ƿ�У���ͼ����һ��û�г������ɵ���( )
X | Y | Z |
| |
A | NO2 | SO2 | BaCl2 | |
B | CO2 | SO2 | CaCl2 | |
C | NH3 | CO2 | BaCl2 | |
D | NH3 | CO2 | Al2(SO4)3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ṩ����Ϣ���������ý�����ȷ���ǣ� �� 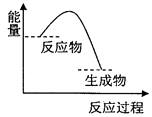
A.�÷�Ӧ�����У��γ��»�ѧ���ͷŵ�������С�ڶ��Ѿɻ�ѧ�����յ�������
B.��Ϊ����������������ڷ�Ӧ��������������Ը÷�Ӧ����Ҫ���ȼ��ɽ���
C.��ͼ����Ա�ʾ̼������ȷֽ�������仯
D.��ͼ����Ա�ʾп��ϡ���ᷴӦ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ�����ܲ��������ЧӦ����
A. ���� B. Fe(OH)3���� C. ҽ�þƾ� D. ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������m��p��q��r��s������ЩԪ����ɵĶ�Ԫ��������³�ѹ��rΪҺ�壬�����Ϊ��ɫ���壬m��Ħ������Ϊp��2����n��Ԫ��Y�ĵ��ʣ�����ɫֲ�������ò�������ɫ���壬p��ʹʪ��ĺ�ɫʯ����ֽ������q��ʹƷ����Һ��ɫ����������֮���ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 
A.ԭ�Ӱ뾶��X��Y��Z
B.�ǽ����ԣ�X��Y��Z
C.W��X��Y��Z����Ԫ�ؿ��γ����ӻ�����
D.q��s��Ϊ���������m��ˮ��Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���Ҵ����Ӷ��ѵĽ���̼�������ǣ� ��
A.�Ҵ�������Ʒ�Ӧ��������
B.�Ҵ���Ũ����140�������·�Ӧ
C.�Ҵ�����±�ᷢ��ȡ����Ӧ����±����
D.�Ҵ��������ظ���ص�������������ȩ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ƽ�ⳣ��K��˵����ȷ����
A. ��֪̼��: K1=4.4��10-7,K2=4.7��10-11,������: K1=2.98��10-8��̼������Һ�еμ�������ˮ�����ӷ���ʽΪ: CO32-+Cl2+H2O=HCO3-+Cl-+HClO
B. 1.0mol/LNH4HCO3��ҺpH=8.0���ɴ˿�֪Ka1(H2CO3)> Kb(NH3��H2O)>Ka2(H2CO3)
C. �����µ��볣��ΪKa ����HA��Һ��c(H+)= ![]()
D. ��0.1mol/LMgSO4��Һ����NaOH ��Һ���������г����������ٵμ�0.1mo/LCuSO4��Һ����ɫ������Ϊ��ɫ�������ɵó�Ksp[Cu(OH)2]sp[Mg(OH)2]
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com