
【题目】根据如图提供的信息,下列所得结论正确的是( ) 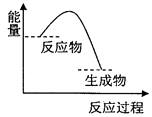
A.该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量
B.因为生成物的总能量低于反应物的总能量,所以该反应不需要加热即可进行
C.该图象可以表示碳酸钙受热分解的能量变化
D.该图象可以表示锌与稀硫酸反应的能量变化
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 蒸发操作时,应使混合物中的水分少量剩余时,才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示,图中有机废水中有机物可用C6Hl0O5表示。下列有关说法正确的是( )

A. 电解精炼铜应将粗铜连接在a电极上
B. b电极附近溶液的pH减小
C. 中间室:Na+移向左室,Cl-移向右室
D. a电极反应式C6H10O5-24e-+7H2O=6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g) ![]() 2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如右下图所示,下列说法正确的是( )
2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如右下图所示,下列说法正确的是( )
容器 | 容积/L | 起始物质的量/L |
| ||
N2O | N2 | O2 | |||
I | V1 | 0.1 | 0 | 0 | |
II | 1.0 | 0.1 | 0 | 0 | |
III | V2 | 0.1 | 0 | 0 | |
IV | 1.0 | 0.06 | 0.06 | 0.04 | |
A. 该反应的正反应放热
B. 相同温度下反应时,平均反应速率:v(I)>v(Ⅲ)
C. 图中A、B、C三点处容器内总压强:V(III)<V(II)<V(I)
D. 容器IV在470℃进行反应时,起始速率:v(N2O)正<v(N2O)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中SO2和Nox是形成酸雨的主要物质,危害环境.
(1)某研究小组为了探究参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2 , 该过程中发生的化学反应有、; 再喷射适量蒸馏水即可得硫酸型酸雨,其中NO的作用是 .
(2)减少SO2的污染并变废为宝是一项很重要的研究工作.我国正在探索在一定条件下用CO还原SO2得到单质硫得方法来除去SO2 , 该反应的化学方程式为 .
(3)有人提出:用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4来脱除烟气中的SO2 , 原因是(用离子方程式表示)
(4)为防止污染,将NO、NO2完全转化为最高价含氧酸盐,消耗1L2.4mol/LnaOH溶液和1molO2 , 则两种气体的物质的量分别为、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的化学方程式为____________________________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色 时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:______。
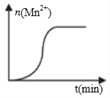
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】颠茄酸酯(J)是一种溃疡病治疗的辅助药物,其合成路线如下,回答下列问题:

(1)烃B其相对分子质量小于118,分子中氢的质量分数为7.69%,且反应I为加成反应,则X含有的官能团的名称是_______________。B的名称为_______________。
(2)反应3的反应类型为_______________。
(3)C的结构简式为_______________。
(4)写出D→E反应的化学方程式_______________。
(5)反应2的化学方程式为_______________。
(6)化合物I有多种同分异构体,同时满足下列条件的结构有______种。
①能发生水解反应和银镜反应;②能与FeCl3发生显色反应;
③苯环上有四个取代基,且苯环上一卤代物只有一种
(7)参照颠茄酸酯的合成路线,设计一条以 为起始原料制备
为起始原料制备 的合成路线。______________
的合成路线。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B为单质,C为淡黄色固体,A、B、C、D、E、F有如下转化关系
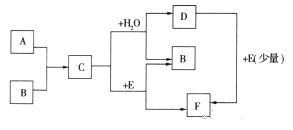
(1)写出A、B、E的化学式:
A_________________,B_________________,E___________________。
(2)完成下列化学反应方程式:
①C+H2O:__________________________________。
②D+E:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH将收制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A. 镍是阳极,电极反应为4OH--4e-=O2↑+2H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe→电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com