
����Ŀ��������SO2��Nox���γ��������Ҫ���ʣ�Σ��������
��1��ij�о�С��Ϊ��̽�������������������γɣ�����ƿ�г��뺬������NO��SO2���壬����ͨ��O2 �� �ù����з����Ļ�ѧ��Ӧ������ ��������������ˮ���ɵ����������꣬����NO�������� ��
��2������SO2����Ⱦ�����Ϊ����һ�����Ҫ���о��������ҹ�����̽����һ����������CO��ԭSO2�õ�������÷�������ȥSO2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3������������ð�ˮ��SO2ת��ΪNH4HSO3 �� �������ɣ�NH4��2SO4���ѳ������е�SO2 �� ԭ�����������ӷ���ʽ��ʾ��
��4��Ϊ��ֹ��Ⱦ����NO��NO2��ȫת��Ϊ��ۺ������Σ�����1L2.4mol/LnaOH��Һ��1molO2 �� ��������������ʵ����ֱ�Ϊ�� ��
���𰸡�
��1��2NO+O2=2NO2��NO2+SO2=SO3+NO������
��2��SO2+2CO ![]() S+2CO2
S+2CO2
��3��4NH3+2SO2+2H2O+O2=4NH4++2SO42��
��4��0.8 molNO��1.6 molNO2
���������⣺��1��һ���������л�ԭ�ԣ������ױ�������������Ӧ�ķ���ʽΪ��2NO+O2=2NO2 �� ���������ܽ�����������������Ӧ�Ļ�ѧ����ʽΪ��NO2+SO2=SO3+NO���ܷ�ӦΪ��2SO2+O2=2SO3 �� �ɼ���������һ������������û�б仯����NO�ڷ�Ӧ���������� ���Դ��ǣ�2NO+O2=2NO2��NO2+SO2=SO3+NO����������2��CO��ԭSO2�õ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��SO2+2CO ![]() S+2CO2 ��
S+2CO2 ��
���Դ��ǣ�SO2+2CO ![]() S+2CO2����3��������������ͨ�백ˮ��������������泥���ѧ����ʽΪ��SO2+H2O+NH3=NH4HSO3 �� ��Ӧ���ӷ���ʽΪ��NH3+SO2+H2O=NH4++HSO3�� �� +4�۵�������������+6�۵������ӷ�ӦΪ��4NH3+2SO2+2H2O+O2=4NH4++2SO42�� ��
S+2CO2����3��������������ͨ�백ˮ��������������泥���ѧ����ʽΪ��SO2+H2O+NH3=NH4HSO3 �� ��Ӧ���ӷ���ʽΪ��NH3+SO2+H2O=NH4++HSO3�� �� +4�۵�������������+6�۵������ӷ�ӦΪ��4NH3+2SO2+2H2O+O2=4NH4++2SO42�� ��
���Դ��ǣ�4NH3+2SO2+2H2O+O2=4NH4++2SO42������4����NO��NO2��ȫת��Ϊ��ۺ������Σ�NO��NO2����ת��ΪNaNO3 �� 1mol�������뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ4mol�����NO��NO2�����ʵ����ֱ�Ϊxmol��ymol����x+y=2.4����ԭ���غ㣩��3x+y=4�������غ㣩����ã�x=0.8��y=1.6��
���Դ��ǣ�0.8 molNO��1.6 molNO2 ��
�����㾫����������Ҫ�����˶����������Ⱦ�����������֪ʶ�㣬��Ҫ����SO2����Ⱦ��������Ҫ�к�����֮һ��ֱ��Σ��������������������γ�����pH��5��6���ƻ�ũ���ɭ�֡���ԭ��ʹ����������ǿ�ȵȣ���SO2�Ĺ�ҵ�������뾭���������������ŷŵ������в�����ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܱ������еķ�Ӧ��N2(g) +3H2(g)![]() 2NH3(g)����H��0��673K��30MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����
2NH3(g)����H��0��673K��30MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����

A. ��a������Ӧ���ʱȵ�b�Ĵ�
B. ��c����Ӧ�ﵽƽ��
C. ��d(t1ʱ��) �͵�e(t2ʱ��) ��n(N2)һ����
D. �����������䣬773 K�·�Ӧ��t2ʱ�̣�n(NH3)����ͼ��e���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������ڡ����п��������ձ�����������Ⱦ������ ��
A���������� B��������̼ C������������� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������£����һ�����ʵ���Ũ�ȵ�CuSO4��Һһ��ʱ�����0.2molCu(OH)2����ʹ��Һ��ȫ�ָ�����ʼ״̬����˹����й���������
A. 6.72L B. 8.96L C. 11.2L D. 5.6L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ϊ����ij��θ�����ڷ�ҩ�����������������������ĸ����� ( )
A. ���� B. ���� C. ���� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ṩ����Ϣ���������ý�����ȷ���ǣ� �� 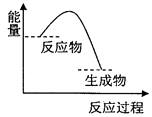
A.�÷�Ӧ�����У��γ��»�ѧ���ͷŵ�������С�ڶ��Ѿɻ�ѧ�����յ�������
B.��Ϊ����������������ڷ�Ӧ��������������Ը÷�Ӧ����Ҫ���ȼ��ɽ���
C.��ͼ����Ա�ʾ̼������ȷֽ�������仯
D.��ͼ����Ա�ʾп��ϡ���ᷴӦ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���֪ʶ�Ʋ�ԭ������Ϊ115��Ԫ�أ����ж�����������ȷ���� �� ��
��λ�ڵ�7���� �ڷǽ���Ԫ�� ��������Ӳ���5������ ��û�з����� �����ڵ���Ԫ�� �������ϵԪ��
A. �٢ۢ� B. �ڢܢ� C. �٢ۢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����100 mL���Ȼ���14.6 g��������Һ�����5.60 g�����ۣ������Ƿ�Ӧǰ����Һ����ı仯������Ӧ��ʼ��2 minĩ���ռ���1.12 L����״�����������ڴ�֮���־���4 min��������ȫ�ܽ⡣��
��1����ǰ2 min����FeCl2��ʾ��ƽ����Ӧ������_____________________��
��2���ں�4 min����HCl��ʾ��ƽ����Ӧ������______________________��
��3��ǰ2 min���4 min��ȣ���Ӧ���ʽϿ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���л�������A��F���ת����ϵ��ͼ��DΪʯ���ѽ����Ҫ����֮һ��D�ڱ�״���µ��ܶ�Ϊ1.25 g��L-1��C�ܷ���������Ӧ��FΪ����ζ����״Һ�塣

��ش�
��1���л���B�к��еĹ�����������________________
��2��D��B�ķ�Ӧ������______________________
��3��B��E��F�Ļ�ѧ����ʽ��__________________________________________
��4�������й�˵����ȷ����______________��
a���ڼ��������£��л���A��C����ʹ���Ƶļ���������ͭ����Һ����ש��ɫ������
b��F�ڼ��������¼���ˮ������ȡ����Ӧ���ֽ�������Ӧ��
c��D��������һ�������·�ӦҲ�����Ƶ�C��E��
d���л���B���Ƿ����E���ý����ƽ��м�⡣
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com