
【题目】在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是_____________________。
(2)在后4 min内用HCl表示的平均反应速率是______________________。
(3)前2 min与后4 min相比,反应速率较快的是____________。
【答案】 0.25 mol·L-1·min-1 0.25 mol·L-1·min-1 前2 min
【解析】(1)反应前氯化亚铁的物质的量为0;
Fe+2HCl=FeCl2 + H2 ↑
56g 1mol
2.8g 0.05mol
v(FeCl2 )= ![]() =
=![]() =
=![]() =0.25mol/(L·min),故答案为:0.25mol/(L·min);
=0.25mol/(L·min),故答案为:0.25mol/(L·min);
(2)反应前氯化氢的物质的量为![]() =0.4mol,铁的物质的量为
=0.4mol,铁的物质的量为![]() =0.1mol,结合方程式知,氯化氢过量.通过(1)知,前两分钟,铁反应2.8g,还剩2.8g;后4min,铁反应2.8g,
=0.1mol,结合方程式知,氯化氢过量.通过(1)知,前两分钟,铁反应2.8g,还剩2.8g;后4min,铁反应2.8g,
Fe + 2HCl=FeCl2 +H2 ↑
56g 2 mol
2.8g 0.1mol
所以氯化氢的物质的量的变化量为0.1mol,
所以后4min内v(HCl)= ![]() =
=![]() =0.25mol/(L·min),故答案为:0.25mol/(L·min);
=0.25mol/(L·min),故答案为:0.25mol/(L·min);
(3)根据同一反应、同一时间段内中,各物质的反应速率之比等于计量数之比,所以前两分钟内,氯化氢的平均反应速率为0.5mol/(L·min);后4min内,氯化氢的平均反应速率为0.25mol/(L·min),所以前两分钟内反应速率快,原因是:随着反应的进行,氢离子的浓度不断减小,所以反应速率降低,故答案为:前2min。


科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.7 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.7 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为
A. 2.8 B. 18.8 C. 21.6 D. 29.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中SO2和Nox是形成酸雨的主要物质,危害环境.
(1)某研究小组为了探究参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2 , 该过程中发生的化学反应有、; 再喷射适量蒸馏水即可得硫酸型酸雨,其中NO的作用是 .
(2)减少SO2的污染并变废为宝是一项很重要的研究工作.我国正在探索在一定条件下用CO还原SO2得到单质硫得方法来除去SO2 , 该反应的化学方程式为 .
(3)有人提出:用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4来脱除烟气中的SO2 , 原因是(用离子方程式表示)
(4)为防止污染,将NO、NO2完全转化为最高价含氧酸盐,消耗1L2.4mol/LnaOH溶液和1molO2 , 则两种气体的物质的量分别为、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】颠茄酸酯(J)是一种溃疡病治疗的辅助药物,其合成路线如下,回答下列问题:

(1)烃B其相对分子质量小于118,分子中氢的质量分数为7.69%,且反应I为加成反应,则X含有的官能团的名称是_______________。B的名称为_______________。
(2)反应3的反应类型为_______________。
(3)C的结构简式为_______________。
(4)写出D→E反应的化学方程式_______________。
(5)反应2的化学方程式为_______________。
(6)化合物I有多种同分异构体,同时满足下列条件的结构有______种。
①能发生水解反应和银镜反应;②能与FeCl3发生显色反应;
③苯环上有四个取代基,且苯环上一卤代物只有一种
(7)参照颠茄酸酯的合成路线,设计一条以 为起始原料制备
为起始原料制备 的合成路线。______________
的合成路线。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与电化学腐蚀无关的是
A. 切过咸菜的菜刀不及时清洗易生锈
B. 线路连接时,有经验的电工从不把铝导线和铜导线接在一起
C. 银质奖章久置后表面逐渐变暗
D. 在轮船的尾部和船壳的水线以下,常装有一定数量的锌块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B为单质,C为淡黄色固体,A、B、C、D、E、F有如下转化关系
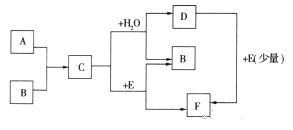
(1)写出A、B、E的化学式:
A_________________,B_________________,E___________________。
(2)完成下列化学反应方程式:
①C+H2O:__________________________________。
②D+E:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 还含有Fe2O3、SiO2)提取氧化铝,冶炼铝的原料,提取的操作过程如图:
请回答下列问题:
(1)写出步骤①中发生反应的离子方程式;滤渣①的成分为 .
(2)写出步骤②中生成含铝化合物的化学方程式;能否将此步骤中的NaOH 溶液更换为氨水?(填“能”或“不能”).若不能,请说明理由:(若能,则此空不答).
(3)步骤③中的X 为(填化学式),发生反应的离子方程式为 .
(4)若铝土矿的质量为mkg,最后得到A12O3的质量为nkg(忽略提取过程中铝元素的损失),则铝土矿中铝元素的质量分数为(用含m、n 的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射嫦娥三号的长征三号乙运载火箭,其中第3级火箭中的能源物质为液态H2和液态O2,发生的反应为2H2(g)+O2(g)===2H2O(g)。下列说法不正确的是( )

A. 化合反应都是放热反应
B. 2 mol气态H2与1 mol气态O2的总能量大于2 mol水蒸气的总能量
C. 断裂2 mol H—H键、1 mol O—O键吸收的总能量小于形成4 mol H—O键释放的总能量
D. 氢气燃烧过程中能量变化可用如图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X,Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( ) 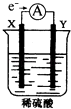
A.X极上发生的是还原反应
B.若两电极分别为Fe和碳棒,则Y为Fe
C.若反应进行一段时间后,产生2克H2时转移了1mol电子
D.溶液中的SO42﹣向X极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com