
����Ŀ����ҵ������������Ҫ�ɷ�ΪAl2O3 �� ������Fe2O3��SiO2����ȡ��������ұ������ԭ�ϣ���ȡ�IJ���������ͼ��
��ش��������⣺
��1��д��������з�����Ӧ�����ӷ���ʽ�������ٵijɷ�Ϊ ��
��2��д������������ɺ���������Ļ�ѧ����ʽ���ܷ˲����е�NaOH ��Һ����Ϊ��ˮ������ܡ����ܡ����������ܣ���˵�����ɣ������ܣ���˿ղ��𣩣�
��3��������е�X Ϊ���ѧʽ����������Ӧ�����ӷ���ʽΪ ��
��4���������������Ϊmkg�����õ�A12O3������Ϊnkg��������ȡ��������Ԫ�ص���ʧ����������������Ԫ�ص���������Ϊ���ú�m��n �Ĵ���ʽ��ʾ����
���𰸡�
��1��Fe2O3+6H+=2Fe3++3H2O��Al2O3+6H+=2Al3++3H2O��SiO2
��2��AlCl3+4NaOH=3NaCl+Na[Al��OH��]4��AlC13+4NaOH=3NaCl+NaAlO2+2H2O�����ܣ����ð�ˮ��Fe3+��Al3+���������������߷���
��3��CO2��CO2+[Al��OH��4]��=Al��OH��3��+HCO3��
��4��![]()
���������⣺��1�������ΪAl2O3��Fe2O3��ϡ���ᷴӦ�����κ�ˮ����Ӧ����ʽΪAl2O3+6H+=2Al3++3H2O��Fe2O3+6H+=2Fe3++3H2O��SiO2��ϡ�����Ӧ��Ȼ����ù��˷����õ�����1ΪSiO2�����Դ��ǣ�Fe2O3+6H+=2Fe3++3H2O��Al2O3+6H+=2Al3++3H2O��SiO2����2�������Ϊ����Һ1����Һ1��������AlCl3��FeCl3���м������NaOH��Һ�������Ȼ�������ƫ�����ƣ���Ӧ��AlCl3+4NaOH=3NaCl+Na[Al��OH��]4��AlC13+4NaOH=3NaCl+NaAlO2+2H2O���������백ˮ��Ӧ������������������������Ҳ���������������ӡ������ӷ��룬�ʲ����ð�ˮ����������ƣ����Դ��ǣ�AlCl3+4NaOH=3NaCl+Na[Al��OH��]4��AlC13+4NaOH=3NaCl+NaAlO2+2H2O�����ܣ����ð�ˮ��Fe3+��Al3+���������������߷��룻��3�������Ϊ��ƫ�������м��������X���յõ���������������ӦΪ������̼����ӦΪ��CO2+[Al��OH��4]��=Al��OH��3��+HCO3����
���Դ��ǣ�CO2��CO2+[Al��OH��4]��=Al��OH��3��+HCO3������4���õ�A12O3������Ϊnkg����������Ԫ�ص�����Ϊ ![]() kg��������Ԫ�������غ㣬��ԭ�������е���Ԫ������ҲΪ
kg��������Ԫ�������غ㣬��ԭ�������е���Ԫ������ҲΪ ![]() kg��������������Ԫ�ص���������Ϊ��
kg��������������Ԫ�ص���������Ϊ�� ![]() ��
��
���Դ��ǣ� ![]() ��
��


 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������ڡ����п��������ձ�����������Ⱦ������ ��
A���������� B��������̼ C������������� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���֪ʶ�Ʋ�ԭ������Ϊ115��Ԫ�أ����ж�����������ȷ���� �� ��
��λ�ڵ�7���� �ڷǽ���Ԫ�� ��������Ӳ���5������ ��û�з����� �����ڵ���Ԫ�� �������ϵԪ��
A. �٢ۢ� B. �ڢܢ� C. �٢ۢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����100 mL���Ȼ���14.6 g��������Һ�����5.60 g�����ۣ������Ƿ�Ӧǰ����Һ����ı仯������Ӧ��ʼ��2 minĩ���ռ���1.12 L����״�����������ڴ�֮���־���4 min��������ȫ�ܽ⡣��
��1����ǰ2 min����FeCl2��ʾ��ƽ����Ӧ������_____________________��
��2���ں�4 min����HCl��ʾ��ƽ����Ӧ������______________________��
��3��ǰ2 min���4 min��ȣ���Ӧ���ʽϿ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú������ҵ����ʳ����ʯ��������ҵ��ѪҺ�����й�ú��ʯ�ͼӹ���˵����ȷ����
A. ú�ĸ��������Ҫ�Ǹ����л���
B. ʯ�͵��ѽ⡢�����ú�ĸ������ڻ�ѧ�仯
C. ú���;�������ɵõ������ױ��ȣ�˵��ú�к��б��ͼױ�
D. ʯ�͵��ѻ���˵���������ڸ��������¿��Էֽ�Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T������2 mol X��1 mol Y�������Ϊ1L���ܱ������У���֪��2X(g)+Y(g) ![]() 2Z(s)��H=-M kJ��mol-1��10 min��ﵽƽ�⣬����0.2 mol Z�����ų�����N kJ������˵����ȷ���� ( )
2Z(s)��H=-M kJ��mol-1��10 min��ﵽƽ�⣬����0.2 mol Z�����ų�����N kJ������˵����ȷ���� ( )
A. ��10 minʱ��X�ķ�Ӧ����Ϊ0.02 mol��L-1��min-l
B. ��0��10 min�ڣ�Y�ķ�Ӧ����Ϊ![]() mol��L-1��min-l
mol��L-1��min-l
C. ��������¶���Y��ƽ��ת����
D. ��Ӧ��ƽ�����T����ͨ��ϡ����������ѹǿ����ѧ��Ӧ���ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���V L�ܱ������м���1 mol X�����2 mol Y���壬������Ӧ��X(g)��2Y(g)![]() 3Z(g)���˷�Ӧ�ﵽƽ��ı�־��( )
3Z(g)���˷�Ӧ�ﵽƽ��ı�־��( )
A. �����������ܶȲ���ʱ��仯 B. v��(X)��2v��(Y)
C. ������X��Y��Z��Ũ�Ȳ���ʱ��仯 D. �����ڻ�������ѹǿ����ʱ��仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���л�������A��F���ת����ϵ��ͼ��DΪʯ���ѽ����Ҫ����֮һ��D�ڱ�״���µ��ܶ�Ϊ1.25 g��L-1��C�ܷ���������Ӧ��FΪ����ζ����״Һ�塣

��ش�
��1���л���B�к��еĹ�����������________________
��2��D��B�ķ�Ӧ������______________________
��3��B��E��F�Ļ�ѧ����ʽ��__________________________________________
��4�������й�˵����ȷ����______________��
a���ڼ��������£��л���A��C����ʹ���Ƶļ���������ͭ����Һ����ש��ɫ������
b��F�ڼ��������¼���ˮ������ȡ����Ӧ���ֽ�������Ӧ��
c��D��������һ�������·�ӦҲ�����Ƶ�C��E��
d���л���B���Ƿ����E���ý����ƽ��м�⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����FeI2��Һ�л�õⵥ�ʣ������������ͼ��
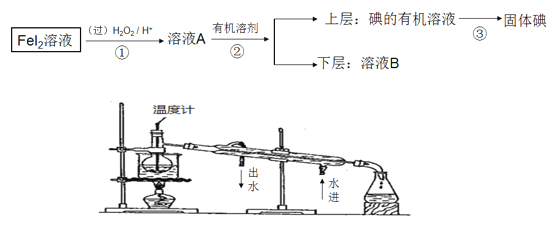
��ش�
��1���������г��ձ��⣬��Ҫ�õ��IJ���������������________________
��2����ͬѧ��ͼ����������ʵ�ֵڢ۲���������ͬѧ�������ͼ��ʵ��װ�ã���װ���е����Դ�����___________________________________
��3����ҺB�ʻ�ɫ�����˺�Fe3+�����ܻ�����I2���������һ��ʵ�鷽������֤�������ʵ�����������__________________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com