
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
A. 在10 min时,X的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 无法计算该温度下Y的平衡转化率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
【答案】B
【解析】A. 化学反应速率表示的是一段时间内的平均速率,不能表示瞬时速率,故无法计算在10 min时,X的反应速率,故A错误;
B. 10 min后达到平衡时,放出热量N kJ,设Y的物质的量减少了a mol,则根据反应方程式有:
2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1
2Z(s)△H=-M kJ·mol-1
1mol MkJ
amol NkJ
得a=![]() mol,则v(Y)=
mol,则v(Y)= ![]() =
= 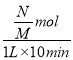 =
=![]() mol·L-1·min-l,故B正确;
mol·L-1·min-l,故B正确;
C. 10 min后达到平衡,生成0.2 mol Z,根据反应方程式可知,此时消耗Y的物质的量是0.1mol,则Y的平衡转化率为: ![]() ×100%=10%,故C错误;
×100%=10%,故C错误;
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,但因容器恒容,故反应物的浓度不变,反应速率不变,故D错误;
故答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示,图中有机废水中有机物可用C6Hl0O5表示。下列有关说法正确的是( )

A. 电解精炼铜应将粗铜连接在a电极上
B. b电极附近溶液的pH减小
C. 中间室:Na+移向左室,Cl-移向右室
D. a电极反应式C6H10O5-24e-+7H2O=6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】颠茄酸酯(J)是一种溃疡病治疗的辅助药物,其合成路线如下,回答下列问题:

(1)烃B其相对分子质量小于118,分子中氢的质量分数为7.69%,且反应I为加成反应,则X含有的官能团的名称是_______________。B的名称为_______________。
(2)反应3的反应类型为_______________。
(3)C的结构简式为_______________。
(4)写出D→E反应的化学方程式_______________。
(5)反应2的化学方程式为_______________。
(6)化合物I有多种同分异构体,同时满足下列条件的结构有______种。
①能发生水解反应和银镜反应;②能与FeCl3发生显色反应;
③苯环上有四个取代基,且苯环上一卤代物只有一种
(7)参照颠茄酸酯的合成路线,设计一条以 为起始原料制备
为起始原料制备 的合成路线。______________
的合成路线。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B为单质,C为淡黄色固体,A、B、C、D、E、F有如下转化关系
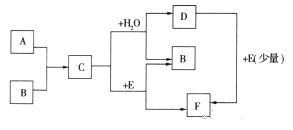
(1)写出A、B、E的化学式:
A_________________,B_________________,E___________________。
(2)完成下列化学反应方程式:
①C+H2O:__________________________________。
②D+E:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 还含有Fe2O3、SiO2)提取氧化铝,冶炼铝的原料,提取的操作过程如图:
请回答下列问题:
(1)写出步骤①中发生反应的离子方程式;滤渣①的成分为 .
(2)写出步骤②中生成含铝化合物的化学方程式;能否将此步骤中的NaOH 溶液更换为氨水?(填“能”或“不能”).若不能,请说明理由:(若能,则此空不答).
(3)步骤③中的X 为(填化学式),发生反应的离子方程式为 .
(4)若铝土矿的质量为mkg,最后得到A12O3的质量为nkg(忽略提取过程中铝元素的损失),则铝土矿中铝元素的质量分数为(用含m、n 的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3的性质,下列说法正确的是(双选)( )
A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少
B.相同温度下溶解度比Na2CO3要大
C.热稳定性比Na2CO3大
D.NaHCO3只能和酸作用不能和碱作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射嫦娥三号的长征三号乙运载火箭,其中第3级火箭中的能源物质为液态H2和液态O2,发生的反应为2H2(g)+O2(g)===2H2O(g)。下列说法不正确的是( )

A. 化合反应都是放热反应
B. 2 mol气态H2与1 mol气态O2的总能量大于2 mol水蒸气的总能量
C. 断裂2 mol H—H键、1 mol O—O键吸收的总能量小于形成4 mol H—O键释放的总能量
D. 氢气燃烧过程中能量变化可用如图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH将收制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A. 镍是阳极,电极反应为4OH--4e-=O2↑+2H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe→电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知: Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。请回答下列问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119): ①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn 完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是________;此锡粉样品中锡的质量分数为_________。若在滴定终点时俯视读数,则会导致测得的样品中锡的质量分数________(填“偏高“偏低”或“无影响”)。
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤I加入Sn粉的作用:____________及调节溶液pH。
②步骤II用到的玻璃仪器有烧杯、____________。
③步骤III生成SnO的离子方程式: ____________。
④步骤IV中检验SnO是否洗涤干净的操作是____________,证明已洗净。
⑤步骤V操作依次为____________ 、____________过滤、洗涤、低温干燥。
(4)实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com