
【题目】下列各组物质中,气体X和气体Y同时通入 盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是( )
X | Y | Z |
| |
A | NO2 | SO2 | BaCl2 | |
B | CO2 | SO2 | CaCl2 | |
C | NH3 | CO2 | BaCl2 | |
D | NH3 | CO2 | Al2(SO4)3 |
A. A B. B C. C D. D
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】日常生活中常用铝制炊具,它质轻且坚固耐用,其中的原因是( )
A.铝很不活泼,不易与其他物质反应
B.铝虽然很活泼,但是只有在高温下才能与其他物质反应
C.铝制品表面有一层致密的氧化物薄膜,起保护作用
D.铝制品表面镀有一层铜,可以保护铝制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应及其应用在化学中占有重要地位。回答下列各题。
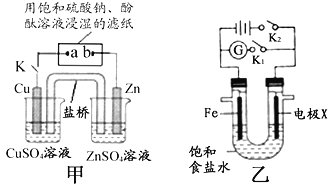
(1)写出铝与氢氧化钠溶液反应的离子方程式____________________;若将镁条、铝条和灵敏电流计用导线相连,使镁条、铝条浸入氢氧化钠溶液中,电流计指针发生偏转时,负极材料为________。
(2)当闭合K时,甲装置中Zn极的电极反应式为____;电子流动的方向为______;若盐桥中填充KCl琼脂,K+离子移动的方向为______;a极的电极反式为________;一段时间后,b极附近的现象为____________________。
(3)装置乙中。
①断开K2,接通K1。当X为石墨电极,Fe极的电极反应式为_________;当X为锌电极,Fe极的电极反应式为_____________。
②断开K1,接通K2。若X为石墨电极,X极的电极名称为_____;装置反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1molL—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/(c(H2A)+c(HA—)+c(A2—)])。下列叙述正确的是

A. Ka2(H2A)的数量级为10-4
B. NaHA溶液中,HA-的水解能力小于HA-的电离能力
C. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,δ(HA-)一定增大
D. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中δ(HA-)=δ(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g) ![]() 2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如右下图所示,下列说法正确的是( )
2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如右下图所示,下列说法正确的是( )
容器 | 容积/L | 起始物质的量/L |
| ||
N2O | N2 | O2 | |||
I | V1 | 0.1 | 0 | 0 | |
II | 1.0 | 0.1 | 0 | 0 | |
III | V2 | 0.1 | 0 | 0 | |
IV | 1.0 | 0.06 | 0.06 | 0.04 | |
A. 该反应的正反应放热
B. 相同温度下反应时,平均反应速率:v(I)>v(Ⅲ)
C. 图中A、B、C三点处容器内总压强:V(III)<V(II)<V(I)
D. 容器IV在470℃进行反应时,起始速率:v(N2O)正<v(N2O)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如图实验流程探宄海带中碘含量的测定和碘的制取. 
已知:己知:3I2+6NaOH═5NaI+NaIO3+3H2O 请回答:
(1)实验中仪器的名称:A , B .
(2)①与②的操作名称(填“相同”或“不相同”)
(3)步骤X为向海带原液中滴加0.0100mol/LAgNO3溶液,当海带原液中不再生成沉淀时,消耗 AgNO3溶液20.00mL,计算得海带中碘的百分含量为 .
(4)步骤Y中,萃取后分液漏斗内观察到的现象是 .
(5)方案甲中采用蒸馏不合理,理由是 .
(6)下列有关步骤Z的说法,正确的是 .
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.NaOH溶液可以由乙醇代替.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的化学方程式为____________________________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色 时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
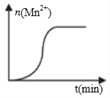
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称量14 g铁放入100 mL 0.1 mol·L-1的CuSO4溶液中,反应析出铜的质量为
A. 0.32 g B. 0.64 g C. 16 g D. 32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com