
【题目】下列有关平衡常数K的说法正确的是
A. 已知碳酸: K1=4.4×10-7,K2=4.7×10-11,次氯酸: K1=2.98×10-8,碳酸钠溶液中滴加少量氯水的离子方程式为: CO32-+Cl2+H2O=HCO3-+Cl-+HClO
B. 1.0mol/LNH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)> Kb(NH3·H2O)>Ka2(H2CO3)
C. 常温下电离常数为Ka 的酸HA溶液中c(H+)= ![]()
D. 将0.1mol/LMgSO4溶液滴入NaOH 溶液中至不再有沉淀产生,再滴加0.1mo/LCuSO4溶液,白色沉淀变为蓝色沉淀,可得出Ksp[Cu(OH)2]sp[Mg(OH)2]
【答案】D
【解析】已知碳酸:K1=4.4×10-7,K2=4.7×10-11,次氯酸:K1=2.98×10-8,碳酸钠溶液中滴加少量氯水的离子方程式为:2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-,故A错误;越弱越水解,1.0mol/LNH4HCO3溶液pH=8.0。由此可知Kb(NH3·H2O)>Ka1(H2CO3)> Ka2(H2CO3),故B错误;常温下电离常数为Ka的酸HA溶液中c(H+)= ![]() ,故C错误;一种沉淀容易转化为比它更难溶的沉淀,将0.1mol/LMgSO4溶液滴入NaOH溶液中至不再有沉淀产生,再滴加0.1mo/LCuSO4溶液,白色沉淀变为蓝色沉淀,可得出Ksp[Cu(OH)2]<Ksp[Mg(OH)2],故D正确。
,故C错误;一种沉淀容易转化为比它更难溶的沉淀,将0.1mol/LMgSO4溶液滴入NaOH溶液中至不再有沉淀产生,再滴加0.1mo/LCuSO4溶液,白色沉淀变为蓝色沉淀,可得出Ksp[Cu(OH)2]<Ksp[Mg(OH)2],故D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的化学方程式为____________________________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色 时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
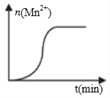
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3的性质,下列说法正确的是(双选)( )
A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少
B.相同温度下溶解度比Na2CO3要大
C.热稳定性比Na2CO3大
D.NaHCO3只能和酸作用不能和碱作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH将收制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A. 镍是阳极,电极反应为4OH--4e-=O2↑+2H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe→电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂贮存方法错误的是( )
A. 钠应保存在石蜡油或煤油中 B. 氢氟酸保存在玻璃瓶中
C. 新制氯水保存在棕色试剂瓶中 D. 烧碱溶液可用带橡皮塞的玻璃瓶暂时保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置. 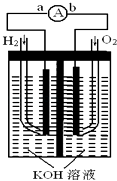
(1)电极b为该燃料电池的极(填“正”或“负”),电极方程式为;
(2)电池工作时,溶液中的OH﹣移向极(填“a”或“b”);
(3)电池工作时,在导线中电子流动方向为(用a、b表示);
(4)电池使用一段时间后,溶液的pH值(填“增大”或“减小”);
(5)当电池工作一段时间后消耗标准状况下H2为6.72L时,转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物莫沙朵林(F)是一-种镇痛药,它的合成路线如下:

(1)A![]() B的转化属于______________反应(填反应类型),1mol B与足量的金属钠反应可以生成标况下的氢气_________L,B的沸点远高于相对分子质量接近的烃类,其原因是_______。
B的转化属于______________反应(填反应类型),1mol B与足量的金属钠反应可以生成标况下的氢气_________L,B的沸点远高于相对分子质量接近的烃类,其原因是_______。
(2)化合物D中含氧官能团的名称为__________
(3)化合物C与新制氢氧化铜悬浊液反应的化学方程式为____________
(4)下列有关化合物E的说法中正确的是__________(填序号)。
A.化合物E的分子式为C9H12O3
B.化合物E能使酸性KMnO4溶液和溴水褪色
C.1mol E发生加成反应最多消耗2 mol H2
D.E中既有非极性共价键也有极性共价键
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:__________;
I.分子的核磁共振氢谱图中有4组峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应,且与溴水反应。
1mol该同分异构体与足量NaOH溶液反应,最多可消耗________molNaOH。
(6)已知E+X![]() F为加成反应,则化合物X的结构简式为__________。
F为加成反应,则化合物X的结构简式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com