
【题目】
A. HCl B. Cl2 C. NH3 D. NO
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
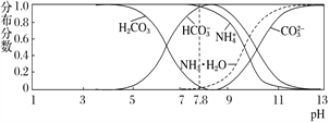
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯气及氯水的叙述中,下列正确的是( )
A.纯净的氯气是一种黄绿色、有毒的气体,具有漂白性
B.可用干燥的石蕊试纸验证氯水是否变质
C.氯气能与铁反应,液氯不宜贮存在钢瓶中
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.欲配制0.18 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________g无水醋酸钠,溶于适量水中,配成500 mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将___________(填“偏大”“偏小”或“无影响”)。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
Ⅱ.某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)写出上述反应的化学方程式______________________________
(2) NaH2PO2 为__________ (填“正盐”或“酸式盐”),
(3)已知NaH2PO2水溶液pH>7,次磷酸的电离方程式为______________________;
NaH2PO2水溶液pH>7的原因:________________________________________。
(4)H3PO2 及 NaH2PO2均可将溶液中的 Ag+ 还原为银,从而可用于化学镀银。
利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:
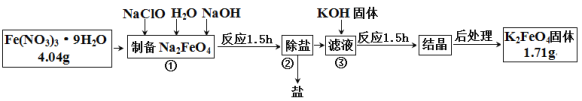
回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐除NaNO3 外,还有 ____________(填化学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4 _____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为__________________。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸入一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。如果标况下产生气体2.24L,则参加反应的FeO42- 数目_____________;K2FeO4作为净水剂的优点除铁无毒,能消毒杀菌外还有__________________________________。
(6)某同学设计以下两个实验探究高铁酸钾的稳定性。
(实验1)将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0mmolL-1(1mmolL-1=10-3molL-1)的试样,静置,结果见图1。
(实验2)将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为1.0mmolL-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,结果见图2。
(实验结论)根据图一,可以得出的结论是:________________________________________
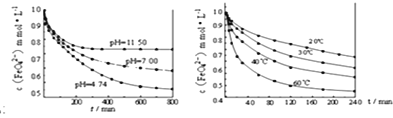
图1 图2
(7)常温下,某水溶液含有Fe3+,Cu2+,调节溶液pH=10时,两种氢氧化物沉淀共存,已知该温度下, Ksp(Fe(OH)3)= a, Ksp(Cu(OH)2)= b,则溶液中C(Fe3+)/C(Cu2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收利用并获得能量,原理如图所示。下列说法正确的是( )
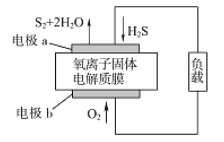
A. 电极b为电池负极
B. 电极a上的电极反应:2H2S+2O2--4e-=S2+2H2O
C. 电极b上的电极反应:O2+4e-+4H+=2H2O
D. 电路中每流过4mol电子,正极消耗44.8LH2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.20 mol的N2O4气体充入1 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间 /(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) / mol · L-1 | 0.20 | c1 | 0.10 | c2 | c3 | c4 |
c(NO2) / mol · L-1 | 0.00 | 0.12 | 0.20 | 0.22 | 0.22 | 0.22 |
根据本题内容和表中提供数据填空(c1、c2、c3、c4表示相应的浓度),请回答下列各小题:
(1)该反应化学方程式_________________________; 表中c2____c3(填“<”、“>”或“=”)
(2)c4=_______mol · L-1,在0~20 s内NO2的平均反应速率为______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com