
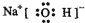 ;氢氧化钠中钠离子和氢氧根离子以离子键相结合,氧和氢以共价键形成氢氧根离子;故答案为:
;氢氧化钠中钠离子和氢氧根离子以离子键相结合,氧和氢以共价键形成氢氧根离子;故答案为: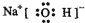 ;离子键、共价键;
;离子键、共价键; ,C2B为Na2O,氧化钠为离子化合物,用电子式表示形成过程为
,C2B为Na2O,氧化钠为离子化合物,用电子式表示形成过程为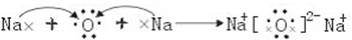 ,
, 、
、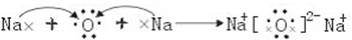 ;
;

科目:高中化学 来源: 题型:
| A、Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B、原子半径由小到大的顺序为:W>X>Z |
| C、Z元素可以形成两种酸性氧化物 |
| D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:
为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
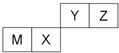
| A、Z位于元素周期表中第2周期、第ⅥA族 |
| B、原子半径Z<M |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、X的最简单气态氢化物的热稳定性比Z的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| E | 740 | 1500 | 7700 | 10500 |
| F | 580 | 1800 | 2700 | 11600 |
| G | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
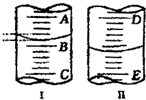 (1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是
(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是查看答案和解析>>
科目:高中化学 来源: 题型:
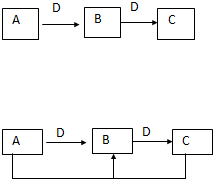 在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题(注:A、B、C中均含有同一种元素):
在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题(注:A、B、C中均含有同一种元素):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=9 |
| B、c(OH-)≈10-5mol?L-1. |
| C、pH≈7 |
| D、c(OH-)≈10-8 mol?L-1. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com