
| 实验步骤 | 实验目的 |
| ①将贝壳煅烧后制成石灰乳. | |
| ②将海水进行浓缩. | |
| ③加入石灰乳沉淀过滤. | 沉淀镁离子生成氢氧化镁沉淀 |
| ④向步骤③所得物质中加入稀盐酸,将溶液进行蒸发浓缩、结晶、过滤. | |
| ⑤将得到的产物干燥除水后,MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑(填化学方程式)得到金属镁. |

分析 Ⅰ.(1)海水提镁的步骤为浓缩海水加入贝壳煅烧后制成的石灰乳,用于沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁固体,向步骤③所得物质氢氧化镁中加入稀盐酸溶解得到氯化镁溶液,将溶液进行蒸发浓缩、结晶、过滤,得到氯化镁晶体,在氯化氢气流中失去结晶水得到固体氯化镁,电解熔融氯化镁得到金属镁,据此回答;
(2)电解生成的氯气可以用来生产盐酸;
Ⅱ.流程分析可知海水则加入氧化剂氯气氧化溴离子为单质溴,通入热空气或水蒸气吹出Br2,利用的是溴单质的易挥发性,用碳酸钠溶液吸收得到溴化钠和溴酸钠,再利用酸溶液中溴酸根离子和溴离子发生氧化还原反应得到溴单质,据此分析回答.
解答 解:Ⅰ.(1)海水提镁的步骤为浓缩海水加入贝壳煅烧后制成的石灰乳,用于沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁固体,向步骤③所得物质氢氧化镁中加入稀盐酸溶解得到氯化镁溶液,将溶液进行蒸发浓缩、结晶、过滤,得到氯化镁晶体,在氯化氢气流中失去结晶水得到固体氯化镁,电解熔融氯化镁得到金属镁,
③是加入石灰乳沉淀过滤,目的是沉淀镁离子生成氢氧化镁沉淀,④向步骤③所得物质中加入稀盐酸,将溶液进行蒸发浓缩、结晶、过滤得到氯化镁晶体,将得到的产物干燥除水后电解熔融氯化镁得到金属镁,反应的化学方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑
故答案为:
| 实验步骤 | 实验目的 |
| 加入石灰乳沉淀过滤 | 沉淀镁离子生成氢氧化镁沉淀 |
| 稀盐酸 | |
| MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ |
点评 本题考查了海水资源的利用分析判断,主要是流程操作的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | 15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 氢键属于化学键,但比较弱 | |
| C. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| D. | 共价化合物中一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
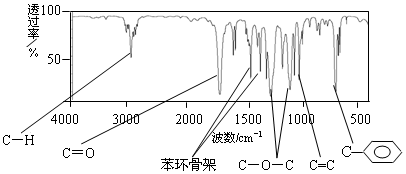
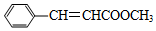 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ; D物质中官能团的名称是羧基.
; D物质中官能团的名称是羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在白磷(P4)晶体中,P原子与P-P键数目比为2:3 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com