
| A. |  | B. |  | ||
| C. |  | D. |  |
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验目的 |
| ①将贝壳煅烧后制成石灰乳. | |
| ②将海水进行浓缩. | |
| ③加入石灰乳沉淀过滤. | 沉淀镁离子生成氢氧化镁沉淀 |
| ④向步骤③所得物质中加入稀盐酸,将溶液进行蒸发浓缩、结晶、过滤. | |
| ⑤将得到的产物干燥除水后,MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑(填化学方程式)得到金属镁. |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol/(L•s) | B. | 0.10 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 2.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 理论解释 | 结论 |
| A | H-N的键能大于H-P | 沸点:NH3>PH3 |
| B | 离子半径:Mg2+<Ba2+ | 热分解温度:碳酸镁髙于碳酸钡 |
| C | 离子半径:Na+<Cs+ | 配位数(C.N.):NaCl<CsCl |
| D | 晶格能:FeS2>ZnS | 岩浆中的硫化物矿物析出顺序ZnS先于FeS2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.| 实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(SO2) | n(NO2) | n(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T2 | 0.20 | 0.30 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
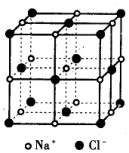 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )| A. | 117α3ρ | B. | $\frac{M}{N{α}^{3}}$ | C. | $\frac{234}{{α}^{3}ρ}$ | D. | $\frac{58.5}{2{α}^{3}ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Al3+含有的核外电子数为3NA | |
| B. | 将5.85 g NaCl溶于100g水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1 mol Cl2与足量的铁反应,转移的电子数为2NA | |
| D. | 常温下,pH=1的硫酸溶液中含有的H+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
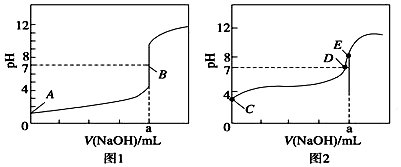
| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com