
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2015-2016学年湖南省高一上学期期中测试化学试卷(解析版) 题型:选择题
现有三组溶液:① 汽油和氯化钠溶液 ② 39%的乙醇溶液 ③ 氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上第一次阶段测化学试卷(解析版) 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l) = H2O(g) ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是_____ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上学期期中测试化学试卷(解析版) 题型:填空题
选择下列实验方法分离物质,将合理的分离方法的字母填在横线上。
A 萃取分液 B 加热分解 C 结晶 D 分液 E 蒸馏 F 过滤
(1)________分离饱和食盐水和沙子的混合物
(2)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)________分离水和苯的混合物
(4)________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物
(5)在“粗盐提纯”的实验中,多次用到玻璃棒,在溶解、过滤、蒸发三个步骤中,玻璃棒所起的作用分别是 ; ;________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.22.4LO2中一定含有6.02×1023个氧分子。
B.将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2 mol/L.
C.18gH2O在标准状况下的体积是22.4L.
D.在标准状况时,20mLNH3与60mLO2所含的分子个数比为1:3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.硝酸银与盐酸反应: AgNO3+Cl-===AgCl↓+NO
B.铜片插入硝酸银溶液中:Cu+Ag+===Ag+Cu2+
C.硫酸和氯化钡溶液反应:Ba2++SO42-===BaSO4↓
D.铁钉放入硫酸铜溶液中:2Fe+3Cu2+===2Fe3++3Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列各组物质中分子数相同的是
A.2 L CO和2 L CO2
B.9 g H2O和标准状况下11.2 L CO2
C.标准状况下1 mol O2和22.4 L H2O
D.0.2 mol H2和4.48 L HCl气体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省金兰教育合作组织高一上学期期中联考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的N2和CO所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.铁的摩尔质量在数值上等于铁原子的相对原子质量
查看答案和解析>>
科目:高中化学 来源:2016届广东省七校联合体高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一, 其原理是利用预焙烧破坏铍矿物(绿柱石—3BeO· Al2O3·6SiO2及少量FeO等)的结构与晶型, 再采用硫酸酸解含铍矿物, 使铍、铝、铁等酸溶性金属进入溶液相, 与硅等脉石矿物初步分离, 然后将含铍溶液进行净化、除杂, 最终得到合格的氧化铍( 或氢氧化铍) 产品, 其工艺流程如右图。
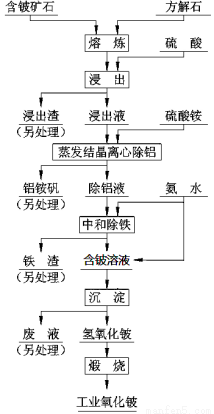
已知:(1)铝铵矾的化学式是NH4Al(SO4)2·12H2O(2)铍元素的化学性质与铝元素相似
根据以上信息回答下列问题:
(1)熔炼物酸浸前通常要进行粉碎,其目的是: ;
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程是_____________________洗涤、过滤。
(3)“中和除铁”过程中“中和”所发生反应的离子方程式是__________________,用平衡原理解释“除铁”的过程_____________________。
(4)加入的“熔剂”除了流程中的方解石外,还可以是纯碱、石灰等。其中, 石灰具有价格与环保优势, 焙烧时配料比( m石灰/ m绿柱石) 通常控制为1:3, 焙烧温度一般为1400℃—1500℃ 。若用纯碱作熔剂,SiO2与之反应的化学方程式是__________________________,若纯碱加入过多则Al2O3、BeO也会发生反应,其中BeO与之反应的化学方程式是_______________________,从而会导致酸浸时消耗更多硫酸,使生产成本升高,结合离子方程式回答成本升高的原因_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com