
| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 含有跟链烃基相连的羟基的有机物一定是醇类 | |
| C. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 分子内有苯环和羟基的化合物一定是酚类 |
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
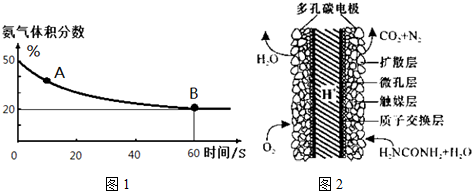
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
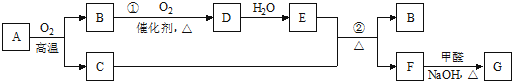
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
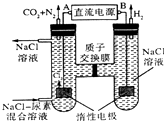
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极,左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol•L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
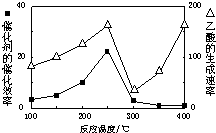
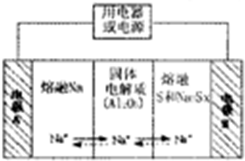
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | |
| B. | 原子半径:W>X>Y>Z | |
| C. | W的最高价氧化物的水化物碱性比X的弱 | |
| D. | Y的简单氢化物的稳定性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:B<N | |
| B. | 硼烷氨分子与乙烷分子结构相似,分子内既含有极性共价键又含有非极性共价键 | |
| C. | 硼烷氨分子中的每个原子均达到最外层8电子稳定结构 | |
| D. | 硼烷氨分子中所有的H原子不可能在同一个平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| D. | 铍(Be)的氧化物的水化物可能具有两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com