
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 简单离子半径:T>R
【答案】D
【解析】试题分析:由短周期元素R、T、Q、W的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素,结合元素周期律与元素化合物性质解答.
解:由短周期元素R、T、Q、W的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素,
A.非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故A正确;
B.非金属性Si<S,故最高价氧化物对应水化物的酸性为H2SiO3<H2SO4,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故C正确;
D.T为Al元素,R为N元素,二者离子具有相同的电子层数,核电荷数越大,离子半径越小,则离子半径:T<R,故D错误;
故选D.


科目:高中化学 来源: 题型:
【题目】化学与人类生活、生产和社会可持续发展密切相关,下列叙述正确的是( )
A.水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品
B.氧化铝和氧化镁都是电解质,工业上可用于电解制取铝和镁
C.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体
D.静电除尘、燃煤固硫、汽车尾气催化净化都可以提高空气质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)2CO(g).
①该反应为 反应(填“吸热”或“放热”).
②该反应的反应速率随时间的变化图象如图所示,则下列说法正确的是 (填序号).
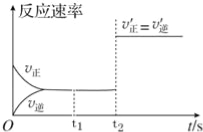
a.t1时刻该反应已经处于化学平衡状态
b.t2时刻c(CO2)=c(CO)
c.t2时刻该反应仍然处于化学平衡状态
d.t2时刻,改变的条件可能是增大了C的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为12.64g KMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请完成并配平下列化学方程式:
K2MnO4+ HCl - KCl+ MnCl2+ Cl2↑+![]()
(2)用酸性高锰酸钾溶液滴定FeSO4溶液写出该反应的离子方程式______________。
(3)当KMnO4固体加热生成O2 a mol值最大时,向反应后残留的固体中加入足量的浓盐酸并加热,产生Cl2的物质的量b= mol。(此时Mn元素全部以Mn2+的形式存在于溶液中)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
(1)从能量的角度看,断开化学键要 (填“放出”或“吸收”)能量.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、300kJ.则由H2和I2反应生成1mol HI需要 (填“放出”或“吸收”) kJ的热量.
(2)某兴趣小组为研究原电池原理,设计如图1装置:
①a和b用导线连接,Zn发生 (填“氧化”或“还原”)反应.其电极反应式为 .溶液H+移向 (填“Cu”或“Zn”)极.
②无论a和b是否连接,Zn片均被腐蚀.若转移了0.4mol电子,则理论上Zn片质量减轻 g.
(3)①目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是 (填序号).
a.以上反应是可逆反应
b.充电时化学能转变为电能
c.放电时化学能转变为电能
②图2为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的 (填“正”或“负”)极,Y极的电极反应方程式为 .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO(g) | CO2(g) | NaOH溶液、浓H2SO4 | 洗气 |
B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C. | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)检验FeCl3溶液中阳离子的方法是
(2)FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)
FeCl3溶液也常用于腐蚀印刷电路板,反应的离子方程式为
(3)通过控制条件,将FeCl3水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O ![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是 (填序号)。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是 (填序号)。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(4)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。完成NaClO3 氧化FeCl2 的离子方程式 。
(5)处理废水时,发现FeCl3并不能使酸性废水中的悬浮物沉降除去,其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.16g CH4所含原子数目为NA
B.1mol·L-1 NaCl溶液含有NA个Na+
C.常温常压下,22.4L CO2中含有NA个CO2分子
D.2.4g Mg与足量盐酸反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烷可制备1,4﹣环己二醇,下列七步有关反应(其中无机产物都已经略去)中,其中有两步属于取代反应,两步属于消去反应,三步属于加成反应,试回答:

(1)写出下列化合物的结构简式:B: C:
(2)反应④所用的试剂和条件分别为:
(3)写出①、④的化学方程式:①: ;④: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com