
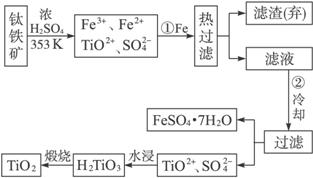
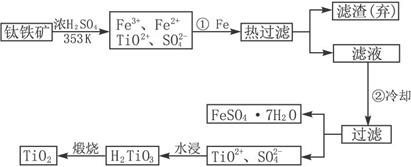
(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是:______________________________________________;
步骤②冷却的目的是:__________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是____________;考虑成本和废物综合利用因素,废液中应加入____________处理。
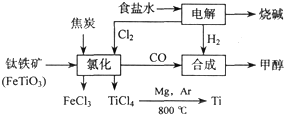
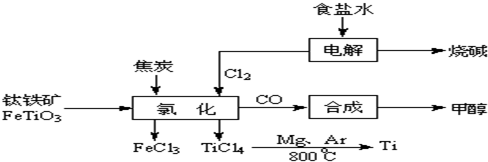
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:①C(s)+O2(g)====CO2(g);ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g) ====2CO2(g);ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) ====TiCl4(s)+O2(g);ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s) ====TiCl4(s)+2CO(g)的ΔH=____________。
反应TiCl4+2Mg====2MgCl2+Ti在Ar环境中进行的理由是______________________。
解析:认真审题,发现第(1)(4)两问分别涉及Ti在周期表中的位置和热化学方程式的加合性,游离于“流程图”之外,而(2)(3)两问与“流程图”密切相关。
由FeTiO3制取TiO2,要实现铁元素和钛元素的分离:经过H2SO4处理后,Fe3+、Fe2+用铁还原为Fe2+之后在低温下析出FeSO4·7H2O晶体;TiO2+水解得到H2TiO3后煅烧而得到TiO2。涉及的化学方程式有:
Fe2O3+3H2SO4====Fe2(SO4)3+3H2O、FeTiO3+2H2SO4====TiOSO4+FeSO4+2H2O、Fe+Fe2(SO4)3====3FeSO4、TiOSO4+2H2O![]() H2TiO3↓+H2SO4、
H2TiO3↓+H2SO4、
H2TiO3![]() TiO2+H2O。
TiO2+H2O。
那么步骤①中加Fe是为了还原Fe3+,②中冷却是为了让FeSO4·7H2O析出。可利用的副产物是绿矾,而废液主要是废酸,宜加入石灰或废碱(成本低)来处理。
答案:(1)4 ⅣB
(2)将Fe3+还原为Fe2+ 析出(或分离、或得到)FeSO4·7H2O
(3)FeSO4·7H2O 石灰(或碳酸钙、废碱)
(4)-80 kJ·mol-1[由①×2-②+③而得。]
防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com