有X、Y、Z、W四种短周期主族元素,原子序数依次增大.X元素与其它元素不在同一周期.Y、Z在同周期表中处于相邻位置,它们的单质在通常状况下均为无色气体.W原子的最外层电子数是核外电子层数的2倍.请回答:
(1)W在元素周期表位置 .
(2)写出X与Z形成的10电子阳离子的化学式 .
(3)由上述四种元素中的某两种元素所形成的具有漂白作用的物质的化学式是: (任意写一种).
(4)W的最高价氧化物的水化物有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为 .
(5)由X、Y、Z、W四种元素组成的多种无机酸酸式盐,写出其中一种与足量的NaOH溶液在加热条件下反应的离子方程式为: .
【答案】
分析:首先确定Y与Z,它们的单质是无色气体,因为第三周期的元素除了氩元素的单质氩气是无色之外,其余的元素中氯元素的气体单质是黄绿色的,剩余的其他元素对应的单质都为固体,而氩并不是主族元素,所以Y和Z不在第三周期,第一周期的也无需考虑,因为氢与氦不相邻,由此确定Y与Z在第二周期,其中第二周期N、O、F、Ne、对应的单质都为气体,氖可以排除,它不是主族元素,而氟气为淡黄色气体,所以确定Y为氮元素,Z为氧元素,第二周期中,在氮之前的元素的都单质都为固体,W原子的最外层电子数是核外电子层数的2倍,则W可能为C或S,由于W的原子序数最大,应为S元素,X元素与其它元素不在同一周期,应为第一周期的主族元素,即H元素,
根据元素对应单质、化合物的性质结合题目信息,解答题中各问.
解答:解:X、Y、Z、W四种短周期主族元素,原子序数依次增大,W原子的最外层电子数是核外电子层数的2倍,则W可能为C或S,由于W的原子序数最大,应为S元素;Y与Z在第二周期,其中第二周期N、O、F、Ne、对应的单质都为气体,氖可以排除,它不是主族元素,而氟气为淡黄色气体,所以确定Y为氮元素,Z为氧元素;X元素与其它元素不在同一周期,应为第一周期的主族元素,即H元素,由以上分析可知,Y为氮元素,Z为氧元素,W为S元素,X为H元素,则
(1)W为S元素,原子核外有3个电子层,最外层电子数为6,则位于周期表中第三周期、VIA族,故答案为:第三周期、VIA族;
(2)X为H元素,Z为氧元素,形成的10电子阳离子为H
3O
+,故答案为:H
3O
+;
(3)在H、N、O、S四种元素中的某两种元素所形成的具有漂白作用的物质有SO
2或H
2O
2,故答案为:SO
2或H
2O
2;
(4)W的最高价氧化物的水化物为H
2SO
4,具有强氧化性,加热时金属铜可被它氧化生成硫酸铜,反应的化学方程式为2H
2SO
4(浓)+Cu
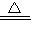
CuSO
4+SO
2↑+2H
2O,
故答案为:2H
2SO
4(浓)+Cu
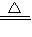
CuSO
4+SO
2↑+2H
2O;
(5)X、Y、Z、W四种元素全为非金属元素,形成的盐只能为铵盐,且酸式盐有NH
4HSO
3或NH
4HSO
4,与足量的NaOH溶液在加热条件下反应的离子方程式分别为NH
4++HSO
3-+2OH
-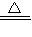
NH
3↑+2H
2O+SO
32-、NH
4++H
++2OH
-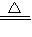
NH
3↑+2H
2O,
故答案为:NH
4++HSO
3-+2OH
-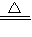
NH
3↑+2H
2O+SO
32-或NH
4++H
++2OH
-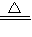
NH
3↑+2H
2O.
点评:本题考查元素的推断及元素化合物的性质,题目难度中等,本题中注意从物质的性质作为推断题的突破口,注意常见无色气体,题中从常见元素化合物的性质入手考查,是一道位置、结构、性质有机结合综合考查学生分析能力、推断能力的典型题目,建议同学们在学习中加强元素化合物的学习和相关知识的积累.

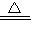 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,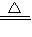 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;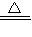 NH3↑+2H2O+SO32-、NH4++H++2OH-
NH3↑+2H2O+SO32-、NH4++H++2OH-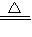 NH3↑+2H2O,
NH3↑+2H2O,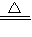 NH3↑+2H2O+SO32-或NH4++H++2OH-
NH3↑+2H2O+SO32-或NH4++H++2OH-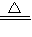 NH3↑+2H2O.
NH3↑+2H2O.



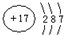
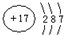


 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: