
【题目】次氯酸钠(NaClO)是漂白液的主要成分,次氯酸钠溶液可用于消毒、杀菌及水处理。一种生产次氯酸钠的工艺如图所示。
-
(1)Cl 元素位于元素周期表第______周期___族。
(2)写出NaOH的电子式:__________。
(3)写出反应②的化学方程式:_______________。该反应中每生成1mol NaClO时,转移______mol 电子。
(4)“84”消毒液( 主要成分为NaClO)和洁厕灵( 主要成分为浓盐酸)不能混在一起使用,原因是_____________________(用离子方程式表示)。
【答案】 三 ⅦA ![]() Cl2+2NaOH=NaClO+NaCl+H2O 1 ClO-+Cl-+2H+=Cl2↑+H2O
Cl2+2NaOH=NaClO+NaCl+H2O 1 ClO-+Cl-+2H+=Cl2↑+H2O
【解析】试题分析:本题以生产NaClO的工艺为载体,考查元素在周期表中的位置,电子式的书写,氧化还原反应方程式的书写和计算。
(1)Cl的原子序数为17,Cl的原子结构示意图为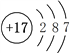 ,Cl元素在元素周期表中处于第三周期VIIA族。
,Cl元素在元素周期表中处于第三周期VIIA族。
(2)NaOH的电子式为![]() 。
。
(3)反应②为Cl2与NaOH反应生成NaClO、NaCl和H2O,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。在该反应中Cl元素的化合价部分由0价升至NaClO中的+1价,部分由0价降至NaCl中的-1价,1molCl2参与反应生成1molNaClO和1molNaCl,转移1mol电子。
(4)NaClO和浓盐酸混合发生归中反应生成Cl2,反应的化学方程式为:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)(氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O![]() 2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂
B. 若1mol NF3被氧化,反应转移电子数为2NA
C. 若生成0.4molHNO3,则转移0.4mol电子
D. 氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示,X、Y同主族且能形成两种常见的化合物。下列说法正确的是
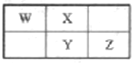
A. 最简单氢化物的稳定性:Z>Y>X
B. 氧化物对应的水化物的酸性:Z>Y
C. Y元素单质在化学反应中只能表现氧化性
D. W的常见气态氢化物可与Z的气态氢化物反应生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.H2O的摩尔质量为18g
B.3.01×1023个SO2分子的质量为32g
C.标准状况下,1 mol任何物质体积均为22.4L
D.将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的说法正确的是( )
A.随着人工合成的同位素种类不断增加,许多元素的相对原子质量也会随之变化
B.第ⅠA族都是金属元素
C.短周期主族元素的族序数一定等于原子的最外层电子数
D.周期表中非金属元素均位于过渡元素右侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属晶体的说法正确的是( )
A.金属晶体中只有金属原子B.金属晶体中存在单个分子
C.金属晶体由金属阳离子和阴离子构成D.金属晶体中有金属阳离子,没有阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属晶体的说法正确的是( )
A.六方最密堆积的晶胞中原子配位数是8
B.晶胞中原子配位数为12的金属一定采取面心立方最密堆积
C.锌的晶胞类型与铜的相同
D.铁的晶胞中空间利用率为68%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com