
【题目】(1)已知:Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑现将9.6g铜完全溶于200mL的硫酸中,试计算
CuSO4+2H2O+SO2↑现将9.6g铜完全溶于200mL的硫酸中,试计算
①标况下产生SO2的体积为_______。
②所生成硫酸铜溶液的物质的量浓度(设反应后溶液的体积为200mL)为_______。
(2)通常情况下,将1体积98%的浓硫酸(密度ρg/cm3)与5体积的水混合得到一种稀硫酸,该硫酸(密度dg/cm3)物质的量浓度为________________________。
(3)一定量的氢气在氯气中燃烧,所得混合物用100ml 3.00mol/L 的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol,原NaOH溶液的质量分数为_________。所得溶液中Cl-的物质的量为________mol。氢气和氯气的物质的量之比n(H2)∶n(Cl2)为____________。
【答案】 3.36L 0.75 mol/L 10ρd/(5+ρ) 10.7% 0.25mol 2∶3
【解析】(1)①9.6g铜的物质的量是9.6g÷64g/mol=0.15mol,根据方程式可知产生0.15mol二氧化硫,标况下SO2的体积为0.15mol×22.4L/mol=3.36L。②根据铜原子守恒可知生成硫酸铜是0.15mol,则所生成硫酸铜溶液的物质的量浓度为0.15mol÷0.2L=0.75 mol/L。(2)假设浓硫酸是1L,则水是5L,硫酸的物质的量是![]() ,溶液质量是5000g+1000ρ,稀释后溶液体积是
,溶液质量是5000g+1000ρ,稀释后溶液体积是![]() ,所以该硫酸的物质的量浓度为
,所以该硫酸的物质的量浓度为![]() ;(3)m(NaOH)=0.1L×3mol/L×40g/mol=12g,m(溶液)=vρ=100mL×1.12g/mL=112g,则ω(NaOH)=12g/112g×100%=10.7%;所得溶液为NaCl和NaClO的混合物,忽略水的电离,根据电荷守恒可知n(Na+)=n(Cl-)+n(ClO-),则n(Cl-)=n(Na+)-n(ClO-)=0.3mol-0.05mol=0.25mol;由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,与H2反应的Cl2为n(Cl2)=0.5×[n(Cl-)-n(NaClO)]=0.5×(0.25mol-0.05mol)=0.1mol=n(H2),则所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=(0.1mol+0.05mol):0.1mol=3:2。
;(3)m(NaOH)=0.1L×3mol/L×40g/mol=12g,m(溶液)=vρ=100mL×1.12g/mL=112g,则ω(NaOH)=12g/112g×100%=10.7%;所得溶液为NaCl和NaClO的混合物,忽略水的电离,根据电荷守恒可知n(Na+)=n(Cl-)+n(ClO-),则n(Cl-)=n(Na+)-n(ClO-)=0.3mol-0.05mol=0.25mol;由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,与H2反应的Cl2为n(Cl2)=0.5×[n(Cl-)-n(NaClO)]=0.5×(0.25mol-0.05mol)=0.1mol=n(H2),则所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=(0.1mol+0.05mol):0.1mol=3:2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)见图。下列说法正确的是( )

A. FeSO4·7H2O晶体中有4种不同结合力的水分子
B. 在100 ℃时,M的化学式为FeSO4·6H2O
C. 在200 ℃时,N的化学式为FeSO4·3H2O
D. 380 ℃的P加热至650 ℃的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是

A. 若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 molL﹣1s﹣1
B. t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C. B的起始物质的量为0.02 mol
D. 该化学反应的表达式为:3A(g)B(g)+2C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.“冰水混合物”是一种分散系B.水溶液中能电离出H+的化合物一定是酸
C.盐中一定含有金属元素D.在氧化还原反应中,金属单质作为反应物只能做还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuS能与HNO3溶液反应,其中S元素被氧化为+6价,且还原产物NO与NO2在同温同压下体积比为1:1,则参加反应的CuS与被还原的HNO3物质的量比为
A. 1:4 B. 1:11 C. 1:6 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列式子:
(1)S2-离子结构示意图____________,CO2的电子式__________________,NH3的结构式_________________。
(2)写出磁铁矿的化学式______________。
(3)写出一水合氨(NH3·H2O)在水中的电离方程式______________。
(4)写出实验室制取氯气的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.H2的燃烧热为285.8 kJ/mol,则H2O电解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol
B.1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为 ![]() CH4(g)+O2(g)═
CH4(g)+O2(g)═ ![]() CO2(g)+H2O(l)△H=﹣445 kJ/mol
CO2(g)+H2O(l)△H=﹣445 kJ/mol
C.已知2C(s)+O2(g)═2CO(g)△H=﹣221 kJ/mol,则C的燃烧热为110.5 kJ/mol
D.HF与NaOH溶液反应:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
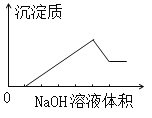
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com