
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
A.该反应中的氧化剂是C12
B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂
C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12
D.根据该反应可判断还原性:S2O32->C1—
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
中华人民共和国国家标准(CB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图(a)装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
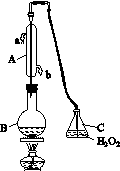
(a)
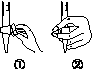
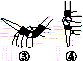
(b)
(1)仪器A的名称是__________________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中的H2O2完全反应,其化学方程式为________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图(b)中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________ g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2014年2月,我国中东部地区遭遇严重的雾霾天气,京津冀地区的空气污染级别高达6级,PM2.5值逼近1000(“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物).下列有关环境污染与防护的说法正确的是 ( )
A.CO,、NO、NO2都是大气污染气体,在空气中能稳定存在
B.使用清洁能源是防止酸雨发生的重要措施之一
C.PM2.5属于胶体,可以通过静电除尘装置除去
D.治理汽车尾气中的CO和NO2,可以通过催化转化装置,转化成无毒的C02和NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子或分子在溶液中能大量共存,且满足相应要求的是 (. )
| 选项 | 离子或分子 | 要求 |
| A | K+ 、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| B | Fe3+、NO3-、SO32-、Cl- | 滴加盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH3COOH | 滴加NaOH溶液立即有气体产生 |
| D | N a+、HCO3-、Mg2+、SO42- | 逐滴滴加氨水立即有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色→①变灰暗→②变白色→③出现液滴→④白色固体,下列说法中正确的是 ( )
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)向MnSO4和硫酸的混合溶液里加入K2S208(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2082-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2S04的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBi03+ MnSO4+ H2S04→ Na2S04+ Bi2(S04)3+ NaMnO4+ H2O
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的氨水和NaOH溶液,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两
溶液的pH仍然相同,则m和n的关系是
A.m<n B.m=n C.m>n D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
① 将5%Na2CO3溶液加入到盛有一定量废铁 屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2至3遍;
屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2至3遍;
② 向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50-80℃之间至铁屑耗尽;
③ 趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④ 待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤ 将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
⑴ 实验步骤①的目的是____________________,加热的作用是__________________。
⑵ 实验步骤②明显不合理,理由是_______________________________。
⑶ 实验步骤④中用少量冰水洗涤晶体,其目的是______________;______________。
⑷ 经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O、和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解 度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27 | ||
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
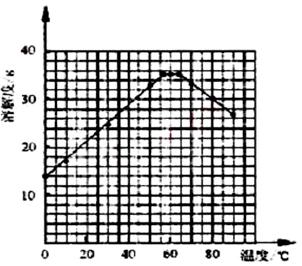
⑸ 若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com