
下列各组离子或分子在溶液中能大量共存,且满足相应要求的是 (. )
| 选项 | 离子或分子 | 要求 |
| A | K+ 、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| B | Fe3+、NO3-、SO32-、Cl- | 滴加盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH3COOH | 滴加NaOH溶液立即有气体产生 |
| D | N a+、HCO3-、Mg2+、SO42- | 逐滴滴加氨水立即有沉淀产生 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
BF3熔点和沸点都比较低,下列有关叙述不正确的是
A.BF3分子中键与键之间的夹角为120° B.BF3中心原子采用sp3杂化
C.BF3分子呈正三角形,中心原子无孤对电子 D.BF3分子立体结构与CO32-相同
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
(1)b中反应的离子方程式为________________,c中试剂为________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是________。
(3)d中的试剂为________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
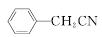 +H2O+H2SO4
+H2O+H2SO4
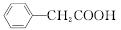 +NH4HSO4
+NH4HSO4
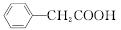 | |||
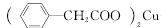 | |||
+Cu(OH)2―→ +H2O
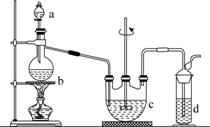
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
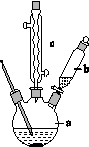
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是____________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是____________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是____________,最终得到44 g纯品,则苯乙酸的产率是____________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是__________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化属于物理变化的是 ( )
A.氧气在放电条件下变成臭氧,
B.胆矾在加热条件下变成白色无水硫酸铜
C.漂白的草帽久置空气中变黄
D.氢氧化铁胶体加入硫酸镁产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
A.该反应中的氧化剂是C12
B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂
C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12
D.根据该反应可判断还原性:S2O32->C1—
查看答案和解析>>
科目:高中化学 来源: 题型:
铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为 。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
 负极:2Fe-4e-=2Fe2+、正极: ;
负极:2Fe-4e-=2Fe2+、正极: ;
② 氢氧化物的形成: Fe2 + + 2OH-= Fe(OH) 2↓ 。
③ 氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。
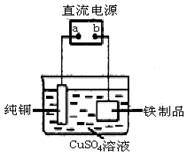
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),
铁制品表面发生的电极反应式 为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的SO2和SO3相比较,下列结论错误的是( )。
A.分子数之比为1∶1 B.所含原子数之比为2∶3
C.质量之比为1∶1 D.氧原子数之比为2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com