
ЁОЬтФПЁПЬМЁЂЕЊЪЧживЊЕФЗЧН№ЪєдЊЫиЃЌдкЩњВњЁЂЩњЛюжагаЙуЗКЕФгІгУЁЃ
(1)вбжЊжВЮяЙтКЯзїгУЗЂЩњЕФЗДгІШчЯТЃК6CO2(g)ЃЋ6H2O(l) ![]() C6H12O6(s)ЃЋ6O2(g) ЁїHЃНЃЋ669.62 kJmolЃ1ИУЗДгІДяЕНЛЏбЇЦНКтКѓЃЌШєИФБфЯТСаЬѕМўЃЌCO2зЊЛЏТЪдіДѓЕФЪЧ__________ЁЃ
C6H12O6(s)ЃЋ6O2(g) ЁїHЃНЃЋ669.62 kJmolЃ1ИУЗДгІДяЕНЛЏбЇЦНКтКѓЃЌШєИФБфЯТСаЬѕМўЃЌCO2зЊЛЏТЪдіДѓЕФЪЧ__________ЁЃ
aЃЎдіДѓCO2ЕФХЈЖШ bЃЎШЁзпвЛАыC6H12O6
cЃЎМгШыДпЛЏМС dЃЎЪЪЕБЩ§ИпЮТЖШ
(2)N2O5ЕФЗжНтЗДгІ2N2O5(g)![]() 4NO2(g) + O2(g)ЃЌгЩЪЕбщВтЕУдк67ЁцЪБN2O5ЕФХЈЖШЫцЪБМфЕФБфЛЏШчЯТЃК
4NO2(g) + O2(g)ЃЌгЩЪЕбщВтЕУдк67ЁцЪБN2O5ЕФХЈЖШЫцЪБМфЕФБфЛЏШчЯТЃК
ЪБМф/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5) /(molLЉ1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
МЦЫудк0ЁЋ2minЪБЖЮЃЌЛЏбЇЗДгІЫйТЪv(NO2) ЃН________molL-1min-1ЁЃ
(3)ШєНЋNO2гыO2ЭЈШыМзжаЩшМЦГЩШчЭМЫљЪОзАжУЃЌDЕчМЋЩЯгаКьЩЋЮяжЪЮіГіЃЌдђAЕчМЋДІЭЈШыЕФЦјЬхЮЊ_________ЃЈЬюЛЏбЇЪНЃЉЃЛAЕчМЋЕФЕчМЋЗДгІЪНЮЊ_______________________ЃЌвЛЖЮЪБМфКѓЃЌШєввжаашМг0.2 mol Cu(OH)2ЪЙШмвКИДдЃЌдђзЊвЦЕФЕчзгЕФЮяжЪЕФСПЮЊ _____________ЁЃ
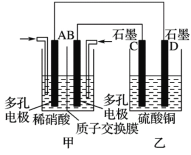
(4)ШєНЋCOКЭNOАДВЛЭЌБШР§ЭЖШывЛУмБеШнЦїжаЗЂЩњЗДгІЃК2CO(g)ЃЋ2NO(g)![]() N2(g)ЃЋ2CO2(g)ЁЁІЄHЃНЃ759.8 kJЁЄmolЃ1ЃЌЗДгІДяЕНЦНКтЪБЃЌN2ЕФЬхЛ§ЗжЪ§Ыцn(CO)/n(NO)ЕФБфЛЏЧњЯпШчЯТЭМ
N2(g)ЃЋ2CO2(g)ЁЁІЄHЃНЃ759.8 kJЁЄmolЃ1ЃЌЗДгІДяЕНЦНКтЪБЃЌN2ЕФЬхЛ§ЗжЪ§Ыцn(CO)/n(NO)ЕФБфЛЏЧњЯпШчЯТЭМ
ЂйbЕуЪБЃЌЦНКтЬхЯЕжаCЁЂNдзгИіЪ§жЎБШНгНќ________________ЃЛ
ЂкaЁЂbЁЂcШ§ЕуCOЕФзЊЛЏТЪДгДѓЕНаЁЕФЫГађЮЊ____________ЃЛaЁЂcЁЂdШ§ЕуЕФЦНКтГЃЪ§ДгДѓЕНаЁЕФЫГађЮЊ__________________ЁЃ
ЂлШє![]() ЃН0.8ЃЌЗДгІДяЦНКтЪБЃЌN2ЕФЬхЛ§ЗжЪ§ЮЊ20%ЃЌдђCOЕФзЊЛЏТЪЮЊ___________ЁЃ
ЃН0.8ЃЌЗДгІДяЦНКтЪБЃЌN2ЕФЬхЛ§ЗжЪ§ЮЊ20%ЃЌдђCOЕФзЊЛЏТЪЮЊ___________ЁЃ
ЁОД№АИЁПd 0.5 NO2 NO2Ѓe-ЃЋH2O=NO3-ЃЋ2HЃЋ 0.8 mol 1ЁУ1 a>b>c aЃНc>d 75%
ЁОНтЮіЁП
ЃЈ1ЃЉaЃЎдіДѓCO2ЕФХЈЖШЃЌЗДгІЮяХЈЖШдіДѓЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌЕЋCO2ЕФзЊЛЏТЪМѕаЁЃЛ
bЃЎИФБфЙЬЬхЕФСПЃЌВЛФмИФБфЗДгІЫйТЪЃЌВЛФмИФБфЦНКтЕФвЦЖЏЗНЯђЃЛ
cЃЎДпЛЏМСФмНЕЕЭЗДгІЕФЛюЛЏФмЃЌМгПьЗДгІЫйТЪЃЌВЛФмИФБфЦНКтЕФвЦЖЏЗНЯђЃЛ
dЃЎИУЗДгІЮЊЮќШШЗДгІЃЌЪЪЕБЩ§ИпЮТЖШЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЛ
ЃЈ2ЃЉгЩЛЏбЇЗДгІЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШПЩЕУv(NO2) ЃН2v(N2O5)ЃЛ
ЃЈ3ЃЉгЩDЕчМЋЩЯгаКьЩЋЮяжЪЮіГіПЩжЊЃЌМзГиЮЊШМСЯЕчГиЃЌЭЈШыЖўбѕЛЏЕЊЕФвЛМЋЮЊИКМЋЃЛМгШыCuЃЈOHЃЉ2ЪЙШмвКИДдЫЕУїЕчНтЙ§ГЬжаЯШЕчНтСђЫсЭШмвКЃЌСђЫсЭШмвКЭъШЋЕчНтКѓЛЙМЬајЕчНтСЫВПЗжЫЎЃЛ
ЃЈ4ЃЉЂйbЕуЪБЃЌN2ЕФЬхЛ§ЗжЪ§зюДѓЃЌдђЗДгІЮяЕФЮяжЪЕФСПжЎБШНгНќЕШгкЛЏбЇМЦСПЪ§жЎБШЃЛ
ЂкдіДѓЗДгІЮяCOЕФХЈЖШЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌNOЕФзЊЛЏТЪдіДѓЃЌCOЕФзЊЛЏТЪМѕаЁЃЌгЩЭМПЩжЊЃЌ![]() ЕФжЕдіДѓЃЛИУЗДгІЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЛЏбЇЦНКтГЃЪ§МѕаЁЃЛ
ЕФжЕдіДѓЃЛИУЗДгІЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЛЏбЇЦНКтГЃЪ§МѕаЁЃЛ
ЂлгЩЬтвтНЈСЂШ§ЖЮЪНЧѓНтПЩЕУЁЃ
ЃЈ1ЃЉaЃЎдіДѓCO2ЕФХЈЖШЃЌЗДгІЮяХЈЖШдіДѓЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌЕЋCO2ЕФзЊЛЏТЪМѕаЁЃЌЙЪДэЮѓЃЛ
bЃЎИФБфЙЬЬхЕФСПЃЌВЛФмИФБфЗДгІЫйТЪЃЌВЛФмИФБфЦНКтЕФвЦЖЏЗНЯђЃЌдђШЁзпвЛАыC6H12O6ЃЌЦНКтВЛвЦЖЏЃЌCO2ЕФзЊЛЏТЪВЛБфЃЌЙЪДэЮѓЃЛ
cЃЎДпЛЏМСФмНЕЕЭЗДгІЕФЛюЛЏФмЃЌМгПьЗДгІЫйТЪЃЌВЛФмИФБфЦНКтЕФвЦЖЏЗНЯђЃЌдђМгШыДпЛЏМСЃЌЦНКтВЛвЦЖЏЃЌCO2ЕФзЊЛЏТЪВЛБфЃЌЙЪДэЮѓЃЛ
dЃЎИУЗДгІЮЊЮќШШЗДгІЃЌЪЪЕБЩ§ИпЮТЖШЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌCO2ЕФзЊЛЏТЪдіДѓЃЌЙЪе§ШЗЃЛ
dе§ШЗЃЌЙЪД№АИЮЊЃКdЃЛ
ЃЈ2ЃЉгЩБэИёЪ§ОнПЩжЊЃЌ0ЁЋ2minФкN2O5ЕФХЈЖШБфЛЏЮЊЃЈ1.00ЁЊ0.50ЃЉmol/L=0.50mol/LЃЌдђv(N2O5) ЃН![]() =0.25 molL-1min-1ЃЌгЩЛЏбЇЗДгІЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШПЩЕУv(NO2) ЃН2v(N2O5) ЃН
=0.25 molL-1min-1ЃЌгЩЛЏбЇЗДгІЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШПЩЕУv(NO2) ЃН2v(N2O5) ЃН![]() ЁС2=0.5molL-1min-1ЃЌЙЪД№АИЮЊЃК0.5ЃЛ
ЁС2=0.5molL-1min-1ЃЌЙЪД№АИЮЊЃК0.5ЃЛ
ЃЈ3ЃЉгЩDЕчМЋЩЯгаКьЩЋЮяжЪЮіГіПЩжЊЃЌМзГиЮЊШМСЯЕчГиЃЌЭЈШыЖўбѕЛЏЕЊЕФвЛМЋЮЊИКМЋЃЌдђAМЋЭЈШыЖўбѕЛЏЕЊЃЌдкЫсадЬѕМўЯТЃЌЖўбѕЛЏЕЊдкИКМЋЪЇШЅЕчзгЗЂЩњбѕЛЏЗДгІЩњГЩЯѕЫсЃЌЕчМЋЗДгІЪНЮЊNO2Ѓe-ЃЋH2O=NO3-ЃЋ2HЃЋЃЛЕчНтСђЫсЭШмвКЕФЛЏбЇЗНГЬЪНЮЊ2CuSO4+2H2OЃЌ![]() 2CuЁ§+O2Ёќ+2H2SO4ЃЌгЩЗНГЬЪНПЩжЊЗДгІКѓжЛЮЪашвЊМгШыCuOЛђCuCO3ОЭПЩвдЪЙШмвКИДдЃЌМгШыCuЃЈOHЃЉ2ЪЙШмвКИДдЫЕУїЕчНтЙ§ГЬжаЯШЕчНтСђЫсЭШмвКЃЌСђЫсЭШмвКЭъШЋЕчНтКѓЛЙМЬајЕчНтСЫВПЗжЫЎЃЌЕчНтЪБЃЌбєМЋЪМжеЪЧOHЃЗХЕчЃЌЕчМЋЗДгІЪНЮЊ4OHЁЊЃ4eЁЊ=2H2O+O2ЁќЃЌЧтбѕЛЏЭЪЧ0.2molЃЌдђИљОнбѕдзгЪиКуПЩжЊЃЌЗДгІжазЊвЦЕФЕчзгЪЧ0.2molЁС2ЁС2ЃН0.8molЃЌЙЪД№АИЮЊЃКNO2ЃЛNO2Ѓe-ЃЋH2O=NO3-ЃЋ2HЃЋЃЛ0.8 molЃЛ
2CuЁ§+O2Ёќ+2H2SO4ЃЌгЩЗНГЬЪНПЩжЊЗДгІКѓжЛЮЪашвЊМгШыCuOЛђCuCO3ОЭПЩвдЪЙШмвКИДдЃЌМгШыCuЃЈOHЃЉ2ЪЙШмвКИДдЫЕУїЕчНтЙ§ГЬжаЯШЕчНтСђЫсЭШмвКЃЌСђЫсЭШмвКЭъШЋЕчНтКѓЛЙМЬајЕчНтСЫВПЗжЫЎЃЌЕчНтЪБЃЌбєМЋЪМжеЪЧOHЃЗХЕчЃЌЕчМЋЗДгІЪНЮЊ4OHЁЊЃ4eЁЊ=2H2O+O2ЁќЃЌЧтбѕЛЏЭЪЧ0.2molЃЌдђИљОнбѕдзгЪиКуПЩжЊЃЌЗДгІжазЊвЦЕФЕчзгЪЧ0.2molЁС2ЁС2ЃН0.8molЃЌЙЪД№АИЮЊЃКNO2ЃЛNO2Ѓe-ЃЋH2O=NO3-ЃЋ2HЃЋЃЛ0.8 molЃЛ
ЃЈ4ЃЉЂйbЕуЪБЃЌN2ЕФЬхЛ§ЗжЪ§зюДѓЃЌдђЗДгІЮяЕФЮяжЪЕФСПжЎБШНгНќЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌгЩЛЏбЇЗНГЬЪНПЩжЊЃЌCЁЂNдзгИіЪ§жЎБШНгНќ1:1ЃЌЙЪД№АИЮЊЃК1:1ЃЛ
ЂкдіДѓЗДгІЮяCOЕФХЈЖШЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌNOЕФзЊЛЏТЪдіДѓЃЌCOЕФзЊЛЏТЪМѕаЁЃЌгЩЭМПЩжЊЃЌ![]() ЕФжЕдіДѓЃЌ aЁЂbЁЂcШ§ЕуCOЕФзЊЛЏТЪГЪМѕаЁЧїЪЦЃЌдђa>b>cЃЛИУЗДгІЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЛЏбЇЦНКтГЃЪ§МѕаЁЃЌгЩЭМПЩжЊЃЌN2ЕФЬхЛ§ЗжЪ§T1>T2ЃЌдђЗДгІЮТЖШT2>T1ЃЌЮТЖШВЛБфЦНКтГЃЪ§ВЛБфЃЌaЁЂcЕФЗДгІЮТЖШЯрЭЌЃЌВЂаЁгкdЃЌдђЦНКтГЃЪ§aЃНc>dЃЌЙЪД№АИЮЊЃКa>b>cЃЛaЃНc>dЃЛ
ЕФжЕдіДѓЃЌ aЁЂbЁЂcШ§ЕуCOЕФзЊЛЏТЪГЪМѕаЁЧїЪЦЃЌдђa>b>cЃЛИУЗДгІЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЛЏбЇЦНКтГЃЪ§МѕаЁЃЌгЩЭМПЩжЊЃЌN2ЕФЬхЛ§ЗжЪ§T1>T2ЃЌдђЗДгІЮТЖШT2>T1ЃЌЮТЖШВЛБфЦНКтГЃЪ§ВЛБфЃЌaЁЂcЕФЗДгІЮТЖШЯрЭЌЃЌВЂаЁгкdЃЌдђЦНКтГЃЪ§aЃНc>dЃЌЙЪД№АИЮЊЃКa>b>cЃЛaЃНc>dЃЛ
ЂлШє![]() ЃН0.8ЃЌЩшCOЕФЬхЛ§ЮЊ0.8LЃЌNOЬхЛ§ЮЊ1LЃЌCOЕФзЊЛЏТЪЮЊaЃЌгЩЬтвтНЈСЂШчЯТШ§ЖЮЪНЃК
ЃН0.8ЃЌЩшCOЕФЬхЛ§ЮЊ0.8LЃЌNOЬхЛ§ЮЊ1LЃЌCOЕФзЊЛЏТЪЮЊaЃЌгЩЬтвтНЈСЂШчЯТШ§ЖЮЪНЃК

гЩN2ЕФЬхЛ§ЗжЪ§ЮЊ20%ПЩЕУ![]() =0.2ЃЌНтЕУa=0.75ЃЌдђCOЕФзЊЛЏТЪЮЊ75%ЃЌЙЪД№АИЮЊЃК75%ЁЃ
=0.2ЃЌНтЕУa=0.75ЃЌдђCOЕФзЊЛЏТЪЮЊ75%ЃЌЙЪД№АИЮЊЃК75%ЁЃ


 аЧМЖПкЫуЬьЬьСЗЯЕСаД№АИ
аЧМЖПкЫуЬьЬьСЗЯЕСаД№АИ УЂЙћНЬИЈДяБъВтЪдОэЯЕСаД№АИ
УЂЙћНЬИЈДяБъВтЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкЯТСаИїзАжУЭМЕФа№ЪіВЛе§ШЗЕФЪЧЃЈ ЃЉ
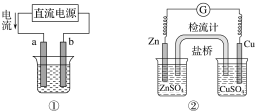
A.гУЭМЂйзАжУЪЕЯжЬњЩЯЖЦЭЃЌaМЋЮЊЭЃЌЕчНтжЪШмвКПЩвдЪЧCuSO4ШмвК
B.ЭМЂкзАжУбЮЧХжаKClЕФClЃвЦЯђгвЩеБ
C.ЭМЂлзАжУжаИжеЂУХгІгыЭтНгЕчдДЕФИКМЋЯрСЌЛёЕУБЃЛЄ
D.ЭМЂмСНИізАжУжаЭЈЙ§ЕМЯпЕФЕчзгЪ§ЯрЭЌЪБЃЌЯћКФИКМЋВФСЯЕФЮяжЪЕФСПВЛЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
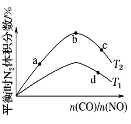
ЁОЬтФПЁПгаЛњЮяFПЩгУгкФГПЙФ§бЊвЉЕФжЦБИЃЌЙЄвЕЩњГЩFЕФвЛжжТЗЯпЭМШчЯТЃЈЦфжаHгыFeCl3ШмвКФмЗЂЩњЯдЩЋЗДгІЃЉЃК
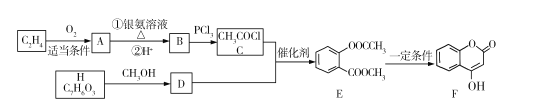
ЛиД№ЯТСаЮЪЬтЃК
(1)AЕФУћГЦЪЧ ___ЃЌEжаЕФЙйФмЭХЪЧУћГЦЪЧ____ЁЃ
(2)BЁњCЕФЗДгІРраЭЪЧ ___ЃЌFЕФЗжзгЪНЮЊ____ЁЃ
(3)HЕФНсЙЙМђЪНЮЊ ___ЁЃ
(4)EгыNaOHШмвКЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ___ЁЃ
(5)ЭЌЪБТњзуЯТСаЬѕМўЕФDЕФЭЌЗжвьЙЙЬхЙВга____жжЃЌаДГіКЫДХЙВеёЧтЦзга5зщЗхЕФЮяжЪЕФНсЙЙМђЪН ___
ЂйЪЧЗМЯузхЛЏКЯЮя
ЂкФмгыNaHCO3ШмвКЗДгІ
ЂлгіЕНFeCl3ШмвКВЛЯдЩЋ
Ђм1molИУЮяжЪгыФЦЗДгІЪБзюЖрПЩЕУЕН1molH2
(6)вд2ТШБћЫсЁЂБНЗгЮЊдСЯжЦБИОлБћЯЉЫсБНЗгѕЅ(![]() )ЃЌаДГіКЯГЩТЗЯпЭМЃЈЮоЛњЪдМСздбЁЃЉ_________ЁЃ
)ЃЌаДГіКЯГЩТЗЯпЭМЃЈЮоЛњЪдМСздбЁЃЉ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіе§ШЗЕФЪЧ()
A. NaClЕФФІЖћжЪСПЪЧ58.5gB. 64gбѕЦјжаКЌга2molбѕ
C. 4gКЄЦјжаКЌга2molКЄдзгD. 0.1molCO2жаКЌга6.02ЁС1022ИіCO2Зжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЫљЪОЪЧЫФжжГЃМћгаЛњЮяЕФБШР§ФЃаЭЪОвтЭМЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )
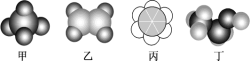
A.МзгыБћЭщЛЅЮЊЭЌЯЕЮя
B.ввПЩгыфхЫЎЗЂЩњМгГЩЗДгІЃЌвВПЩвдБЛЫсадИпУЬЫсМиШмвКбѕЛЏ
C.БћжаЕФЬМЬММќЪЧНщгкЬМЬМЕЅМќКЭЬМЬМЫЋМќжЎМфЕФЖРЬиЕФМќ
D.ЖЁ(CH3CH2OH)ПЩгЩввЯЉгыЫЎЗЂЩњШЁДњЗДгІжЦЕУ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўбѕЛЏЬМЕФВЖМЏЁЂРћгУгыЗтДц(CCUS)ЪЧЮвЙњФмдДСьгђЕФвЛИіживЊеНТдЗНЯђЁЃCO2ПЩзЊЛЏГЩгаЛњЮяЪЕЯжЬМбЛЗЁЃдк 2 L ЕФКуЮТКуШнУмБеШнЦїжаЃЌГфШы 2molCO2 КЭ 6molH2ЃЌвЛЖЈЬѕМўЯТЗЂЩњЗДгІЃКCO2(g)+3H2(g)CH3OH(g)+H2O(g)ЃЌВтЕУ CO2 КЭ CH3OH(g)ЕФХЈЖШЫцЪБМфБфЛЏШчЭМЃК
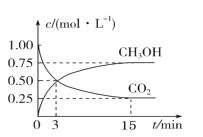
(1)Дг 3 min ЕН 15minЃЌІд(H2)=____molLЃ1minЃ1ЃЛ
(2)ФмЫЕУїЩЯЪіЗДгІДяЕНЦНКтзДЬЌЕФЪЧ_____ЬюБрКХ)ЁЃ
A. ЗДгІжа CO2 гы CH3OH ЕФЮяжЪЕФСПХЈЖШжЎБШЮЊ 1ЁУ1(МДЭМжаНЛВцЕу)
B. ЛьКЯЦјЬхЕФбЙЧПВЛЫцЪБМфЕФБфЛЏЖјБфЛЏ
C. ЕЅЮЛЪБМфФкЩњГЩ 1mol H2ЃЌЭЌЪБЩњГЩ 1mol CH3OH
D. ЛьКЯЦјЬхЕФЦНОљУмЖШВЛЫцЪБМфЕФБфЛЏЖјБфЛЏ
(3)ЦНКтЪБ CO2 ЕФзЊЛЏТЪЮЊ _____ЁЃ
(4)ЦНКтЛьКЯЦјЬхжа CO2(g)КЭ H2(g)ЕФЮяжЪЕФСПжЎБШЪЧ ______ЁЃ
(5)Ек 3 ЗжжгЪБІде§(CH3OH)______Ек 15 ЗжжгЪБІдФц(CH3OH)(ЬюЁАЃОЁБЁЂЁАЃМЁБ ЁА=ЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊжЄУїC2H5XЃЈX=ClЁЂBrЛђ IЃЉжаДцдкфхдзгЃЌФГЭЌбЇЩшМЦШчЯТЪЕбщЃК
ЂёЃЎЯђC2H5XжаМгШыЯѕЫсвјШмвКЃЌГфЗжеёЕДКѓОВжУЃЌвКЬхЗжЮЊСНВуЃЌОљЮЊЮоЩЋШмвКЃЛ
ЂђЃЎЯђC2H5XжаМгШыЧтбѕЛЏФЦШмвКЃЌГфЗжеёЕДКѓОВжУЃЌвКЬхЗжЮЊСНВуЃЌОљЮЊЮоЩЋШмвКЃЛ
ЂѓЃЎШЁЂђжаЁЁЁЃ
(1)ЂёЮЊЖдееЪЕбщЃЌФПЕФЪЧ_______ЁЃ
(2)аДГіЂђжаЕФЛЏбЇЗНГЬЪНЃК_______ЁЃ
(3)ВЙШЋЂѓжаЕФЪЕбщВйзїМАЯжЯѓЃК_______ЃЌЫЕУїC2H5XжаКЌфхдзгЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжга19.2ПЫЭгы400КСЩ§ЯЁЯѕЫсЗЂЩњШчЯТЗДгІ3CuЃЋ8HNO3(ЯЁ)=3Cu(NO3)2ЃЋ2NOЁќЃЋ4H2O
(1)гУЫЋЯпЧХБэЪОГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФП_____________
(2)МЦЫуЯЁЯѕЫсЕФЮяжЪЕФСПХЈЖШ_____________
(3)МЦЫуВњЩњЕФЦјЬхдкБъПіЯТЕФЬхЛ§_____________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
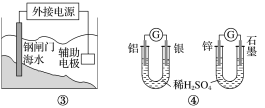
ЁОЬтФПЁПН№ЪєЃЈMЃЉЈCПеЦјЕчГиЃЈШчЭМЃЉОпгадСЯвзЕУЁЂФмСПУмЖШИпЕШгХЕуЃЌгаЭћГЩЮЊаТФмдДЦћГЕКЭвЦЖЏЩшБИЕФЕчдДЁЃИУРрЕчГиЗХЕчЕФзмЗДгІЗНГЬЪНЮЊЃК4M+nO2+2nH2O=4M(OH) nЁЃвбжЊЃКЕчГиЕФЁАРэТлБШФмСПЁБжИЕЅЮЛжЪСПЕФЕчМЋВФСЯРэТлЩЯФмЪЭЗХГіЕФзюДѓЕчФмЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. ВЩгУЖрПзЕчМЋЕФФПЕФЪЧЬсИпЕчМЋгыЕчНтжЪШмвКЕФНгДЅУцЛ§ЃЌВЂгаРћгкбѕЦјРЉЩЂжСЕчМЋБэУц
B. БШНЯMgЁЂAlЁЂZnШ§жжН№ЪєЈCПеЦјЕчГиЃЌAlЈCПеЦјЕчГиЕФРэТлБШФмСПзюИп
C. MЈCПеЦјЕчГиЗХЕчЙ§ГЬЕФе§МЋЗДгІЪНЃК4Mn++nO2+2nH2O+4neЈC=4M(OH)n
D. дкMЈCПеЦјЕчГижаЃЌЮЊЗРжЙИКМЋЧјГСЛ§Mg(OH)2ЃЌвЫВЩгУжаадЕчНтжЪМАбєРызгНЛЛЛФЄ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com