
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol•L-1 |
分析 A.98%的硫酸为浓硫酸,具有强腐蚀性;
B.硫酸的密度大于水,等体积时硫酸溶液的质量大;
C.根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算;
D.硫酸与等质量的水混合所得溶液的体积大于硫酸体积的2倍.
解答 解:A.98%的硫酸为浓硫酸,具有强腐蚀性,属于危险药品,在实验室中应妥善保管,故A正确;
B.硫酸的密度大于水,等体积时硫酸溶液的质量大,所配溶液的质量分数大于49%,故B错误;
C.该浓硫酸的物质的量浓度为c═$\frac{1000ρω}{M}$=$\frac{1000×1.84g/L×98%}{98g/mol}$=18.4mol/L,计算根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则xmL×18.4mol/L=200mL×4.6mol/L,解得:x=50,所以应量取的浓硫酸体积是50mL,故C正确;
D.该硫酸与等质量的水混合,由于硫酸密度大于水的密度,等质量混合时总体积大于硫酸体积的2倍,则所得溶液的物质的量浓度小于9.2 mol•L-1,故D正确;
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,注意硫酸密度比水大的特点,答题中注意把握相关计算公式的运用,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.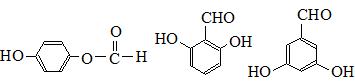 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
. 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
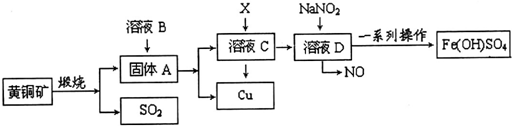

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com