
【题目】为有效提升空气质量,国家强制各燃煤企业要对燃媒烟气进行脱硫、脱硝处理后排放。回答下列问题:
(1)燃煤烟气“脱硝”中涉及到的部分反应如下:
a.4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H1
5N2(g)+6H2O(g)△H1
b.4NH3(B)+5O2(g)![]() 4NO(g)+6H2O(g)△H2=-925kJ·mol-1
4NO(g)+6H2O(g)△H2=-925kJ·mol-1
c.N2(g)+O2(g)![]() 2NO(g)△H3=+175kJ·mol-1
2NO(g)△H3=+175kJ·mol-1
则△H1=_________kJ·mol-1。
(2)向某恒容密闭容器中加入2molNH3、3molINO,在适当条件下发生(1)中反应a,反应过程中NO的平衡转化率随温度T、压强p的变化曲线如图1所示:

①p1_________p2(填“>”“<”或“=”)。
②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,则NO的转化率为_________。
③600℃时,下列各项数据中能表明该反应已达到化学平衡状态的是_________(填标号)。
a.水与NO的生成速率相等 b.混合气体的密度保持不变
c.NH3、N2生成速率比为5∶4 d.容器的总压强保持不变
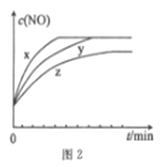
(3)将2molN2、3molH2O(g)、0.5molNO的混合气体置于x、y、z三个容积相同的恒容密闭容器中,控制适当的条件发生反应,反应过程中c(NO)随时间的变化如图2所示。
①在建立平衡的过程中,三个容器中反应速率的相对大小为______________。
②与y容器中反应相比,z容器中反应改变的条件及判断依据分别是____________________________。
(4)2000℃下,在一个2L的密闭容器里发生(1)中反应c,起始时氮气和氧气的浓度均为0.69 mol·L-1,达到平衡时NO的浓度为0.18 mol·L-1,期2000℃时该反应的平衡常数K=__________。
(5)将NO、NO2用NaOH溶液吸收也可消除氮氧化物污染,适当比例的NO、NO2通入NaOH溶液中可得到一种盐X,则该盐的化学式为_________。
【答案】 -1800 > 33.3% ad x>y>z 降低温度,z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低 0.09 NaNO2
【解析】(1)已知b.4NH3(B)+5O2(g)![]() 4NO(g)+6H2O(g)△H2=-925kJ·mol-1
4NO(g)+6H2O(g)△H2=-925kJ·mol-1
c.N2(g)+O2(g)![]() 2NO(g)△H3=+175kJ·mol-1
2NO(g)△H3=+175kJ·mol-1
根据盖斯定律,由b-5 c得反应a.4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) 则△H1=△H2-5△H3=-925kJ·mol-1-5
5N2(g)+6H2O(g) 则△H1=△H2-5△H3=-925kJ·mol-1-5![]() 175kJ·mol-1=-1800kJ·mol-1;(2) ①反应4NH3(g)+6NO(g)
175kJ·mol-1=-1800kJ·mol-1;(2) ①反应4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)是气体体积增大的反应,增大压强,平衡逆向移动,当温度相同时,p2条件下NO的平衡转化率大于p1条件下NO的平衡转化率,故p1> p2;②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,根据反应4NH3(g)+6NO(g)
5N2(g)+6H2O(g)是气体体积增大的反应,增大压强,平衡逆向移动,当温度相同时,p2条件下NO的平衡转化率大于p1条件下NO的平衡转化率,故p1> p2;②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,根据反应4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H1=1=-1800kJ·mol-1可知,反应消耗1 molNO,则NO的转化率为
5N2(g)+6H2O(g) △H1=1=-1800kJ·mol-1可知,反应消耗1 molNO,则NO的转化率为![]() ;③a.水与NO的化学计量数相等,两者的生成速率分别表示正逆反应速率,当两者生成速率相等时,反应达平衡状态,选项a正确;b.反应在恒容容器中进行,参与的反应物均为气体,混合气体的密度始终保持不变,平衡不一定达平衡,选项b错误;c.NH3、N2生成速率比为5∶4 与反应计量数不相等,正逆反应速率不相等,没有达到平衡状态,选项c错误;d.反应为气体体积增大的反应,容器的总压强保持不变说明已达平衡状态,选项d正确。答案选ad;(3)①根据“先拐先平”原则,在建立平衡的过程中,三个容器中反应速率的相对大小为x>y>z;②该反应正反应为放热反应,降低温度平衡正向移动,z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低,故与y容器中反应相比,z容器中反应改变的条件及判断依据分别是降低温度;
;③a.水与NO的化学计量数相等,两者的生成速率分别表示正逆反应速率,当两者生成速率相等时,反应达平衡状态,选项a正确;b.反应在恒容容器中进行,参与的反应物均为气体,混合气体的密度始终保持不变,平衡不一定达平衡,选项b错误;c.NH3、N2生成速率比为5∶4 与反应计量数不相等,正逆反应速率不相等,没有达到平衡状态,选项c错误;d.反应为气体体积增大的反应,容器的总压强保持不变说明已达平衡状态,选项d正确。答案选ad;(3)①根据“先拐先平”原则,在建立平衡的过程中,三个容器中反应速率的相对大小为x>y>z;②该反应正反应为放热反应,降低温度平衡正向移动,z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低,故与y容器中反应相比,z容器中反应改变的条件及判断依据分别是降低温度;
(4) N2(g)+O2(g)![]() 2NO(g)
2NO(g)
开始时的浓度(mol/L) 0.69 0.69 0
改变的浓度(mol/L) 0.09 0.09 0.18
平衡时的浓度(mol/L) 0.60 0.60 0.18
平衡常数K=![]() ;(5)将NO、NO2用NaOH溶液吸收也可消除氮氧化物污染,适当比例的NO、NO2通入NaOH溶液中可得到一种盐X,发生反应为2NaOH+NO+NO2= 2NaNO2+H2O,则该盐的化学式为NaNO2。
;(5)将NO、NO2用NaOH溶液吸收也可消除氮氧化物污染,适当比例的NO、NO2通入NaOH溶液中可得到一种盐X,发生反应为2NaOH+NO+NO2= 2NaNO2+H2O,则该盐的化学式为NaNO2。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是合成某种耐热聚合物的单体,其合成方法如下:

已知:R1COOR2+R3OH ![]() RCOOR3+R2OH
RCOOR3+R2OH
(1)根据系统命名法,A的名称为___ .
(2)上述流程中的取代反应除②、③外还有___(填序号).第⑤步反应中,可使用含有18O的F,将之与C反应,并检测产物中18O的分布情况,从而推断反应机理,这种研究方法称为___ .
(3)化合物E的核磁共振氢谱图中共有多个吸收峰,各峰的峰面积比为___ .
(4)按下列合成路线可得到F的同分异构体H,则可鉴别H与F的试剂是___ .

(5)C与足量NaOH溶液反应的化学方程式为___ .
(6)J与C互为同分异构体,其具有如下性质.符合要求的有机物有___种(不考虑立体异构)
①能与NaOH溶液反应,且1mol J完全反应消耗4mol NaOH
②能发生银镜反应,且1mol J与足量的银氨溶液反应生成4mol Ag
③分子中苯环上的一氯取代物只有一种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲、乙两种有机物在常温常压下的混合物分离。已知它们的物理性质如下:
物质 | 密度/(g/cm3) | 沸点/℃ | 水溶性 | 溶解性 |
甲 | 0.7893 | 68.5 | 溶 | 溶于乙 |
乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
则应采用的分离方法是( )
A. 分液 B. 蒸馏 C. 过滤 D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
铜、银、金与社会生活联系密切。
(1)在周期表中, 铜、银、金位于同一族,它们基态原子的外围电子排布式的通式为__________________(用n表示电子层数),它们位于元素周期表的________区。
(2)化学上,银氨溶液可以检验醛基的存在,例如:H3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3
CH3COONH4+2Ag↓+3NH3
+H2O。1个CH3CHO分子中所含π键的数目为________,碳原子的杂化轨道类型为________;CH3 CH2OH、CH3CHO的相对分子质量仅相差2,但沸点相差很大(分别为78.5℃,20.8℃),其主要原因是________________________;NH3的VSEPR模型为________。
(3)金不溶于硝酸,但溶于“王水”,发生反应:Au+4HCl+HNO3=H[AuCl4]+NO↑+2H2O。金溶于王水的主要原因是形成了[AuCl4],提高了金的活动性。在[AuCl4]-中,金离子的配位数为________,画出该配离子的结构式:________。
(4)金、银、铜都有良好的延展性,解释其原因:________________________________。
(5)金、银的一种合金具有较强的储氢能力。该合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点。若该晶胞边长为anm,金、银原子的半径分别为bnm、cnm。则该晶胞的空间利用率(φ)
为________ (用含a、b、c和圆周率π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO2的平衡物质的量浓度c(CO2)与温度t的关系如图所示。下列说法错误的是 ( )
CO2(g)+H2(g),CO2的平衡物质的量浓度c(CO2)与温度t的关系如图所示。下列说法错误的是 ( )

A. 平衡状态A与C相比,平衡状态A的c(CO)较小
B. 在t2时,D点的反应速率:v(逆)>v(正)
C. 反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)的ΔH>0
CO2(g)+H2(g)的ΔH>0
D. 若t1、t2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 molL-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
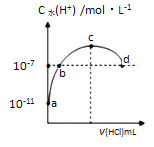
则下列说法正确的是
A. 常温下,0.1molL-1氨水的电离常数K约为1×10-5molL-1
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol CO2 的质量为44g/mol
B. CO2的摩尔质量为44g
C. 64gO2中含有4mol氧原子
D. NA个CO2分子的质量等于CO2的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com