
【题目】已知某密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO2的平衡物质的量浓度c(CO2)与温度t的关系如图所示。下列说法错误的是 ( )
CO2(g)+H2(g),CO2的平衡物质的量浓度c(CO2)与温度t的关系如图所示。下列说法错误的是 ( )

A. 平衡状态A与C相比,平衡状态A的c(CO)较小
B. 在t2时,D点的反应速率:v(逆)>v(正)
C. 反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)的ΔH>0
CO2(g)+H2(g)的ΔH>0
D. 若t1、t2时的平衡常数分别为K1、K2,则K1<K2
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。

(1)当进行适当操作时还需要的仪器有________。
(2)如何进行操作?__________。
(3)实验现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是

A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效提升空气质量,国家强制各燃煤企业要对燃媒烟气进行脱硫、脱硝处理后排放。回答下列问题:
(1)燃煤烟气“脱硝”中涉及到的部分反应如下:
a.4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H1
5N2(g)+6H2O(g)△H1
b.4NH3(B)+5O2(g)![]() 4NO(g)+6H2O(g)△H2=-925kJ·mol-1
4NO(g)+6H2O(g)△H2=-925kJ·mol-1
c.N2(g)+O2(g)![]() 2NO(g)△H3=+175kJ·mol-1
2NO(g)△H3=+175kJ·mol-1
则△H1=_________kJ·mol-1。
(2)向某恒容密闭容器中加入2molNH3、3molINO,在适当条件下发生(1)中反应a,反应过程中NO的平衡转化率随温度T、压强p的变化曲线如图1所示:

①p1_________p2(填“>”“<”或“=”)。
②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,则NO的转化率为_________。
③600℃时,下列各项数据中能表明该反应已达到化学平衡状态的是_________(填标号)。
a.水与NO的生成速率相等 b.混合气体的密度保持不变
c.NH3、N2生成速率比为5∶4 d.容器的总压强保持不变
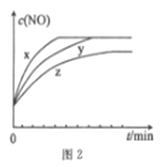
(3)将2molN2、3molH2O(g)、0.5molNO的混合气体置于x、y、z三个容积相同的恒容密闭容器中,控制适当的条件发生反应,反应过程中c(NO)随时间的变化如图2所示。
①在建立平衡的过程中,三个容器中反应速率的相对大小为______________。
②与y容器中反应相比,z容器中反应改变的条件及判断依据分别是____________________________。
(4)2000℃下,在一个2L的密闭容器里发生(1)中反应c,起始时氮气和氧气的浓度均为0.69 mol·L-1,达到平衡时NO的浓度为0.18 mol·L-1,期2000℃时该反应的平衡常数K=__________。
(5)将NO、NO2用NaOH溶液吸收也可消除氮氧化物污染,适当比例的NO、NO2通入NaOH溶液中可得到一种盐X,则该盐的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,请回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是__________________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式有______________________(任写两个)。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程,属于物理变化的是( )
A. 煤通过干馏制取焦炭 B. 石油通过分馏得到汽油
C. 煤通过气化和液化制取清洁燃料 D. 石油通过催化重整获得芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行制备Fe(OH)3胶体的实验。
I、甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25 mL沸水中逐滴加入FeCl3饱和溶液;煮沸至液体呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是________。写出此过程中的化学方程式_____________。
(2)证明制得的红褐色液体属于胶体,最简单实验操作是________。
(3)Fe(OH)3胶体是不是电解质:______(填“是”或“不是”)。
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶体的胶粒带_______电荷。
②向其中加入饱和Na2SO4溶液,产生的现象是________。
③向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为______;继续滴加,沉淀减少甚至最终消失,写出化学方程式________。
④欲除去Fe(OH)3胶体中混有的NaCl,所用仪器物品是____;操作名称是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、R、X、Y为原子序数依次增大的短周期主族元素,Z、W都是第四周期过渡元素。R是同主族元素中最活泼的非金属元素,且能生成MR2型共价化合物, Z和Z2+具有相同的单电子数,Z2+的价电子数是W+的二分之一, W 有W +和W2+两种常见离子,R和X同主族。请回答下列问题(以下均用化学符号表示):
(1)写出R基态原子的电子排布图_________________,M、N和R第一电离能由小到大的顺序是____________。
(2)N的气态氢化物极易溶于R的氢化物,且该体系呈碱性,请用结构式表示出两者主要的结合方式_________________。
(3)在上述元素形成的分子中,有四种分子互为等电子体,分别是MR2、MX2和MRX以及_______,该分子的结构式为___________,N与Y形成的NY3分子的空间构型是________。
(4)M和R所形成MR2晶体以及W晶体的结构都可以如图表示(O表示一个MR2分子或一个W原子),晶体中正八面体和正四面体空隙数的比值是_________,Z的硫化物有3种晶体,其中一种是Z2+为面心立方堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两种离子核间距为acm,则该晶体密度为__________________。
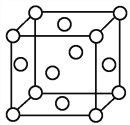
(5)Z的一种氧化物常用来氧化Y的氢化物的水化物的浓溶液制备Y2,该反应的化学方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com