
| 65 |
| x |
| 1 |
| 0.1 |
| 6.5g |
| 65g/mol |


科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| B、Ba(OH)2溶液中逐滴滴加NaHSO4至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
C、用饱和氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O
| ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2 FeO42-+3Cl-+5H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、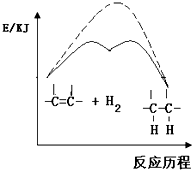 说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下表示 |
B、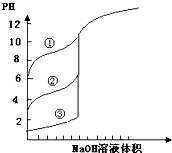 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,曲线可确定①的酸性最强 |
C、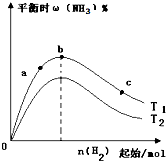 表示合成氨反应在其他条件不变的情况下,改变起始n(H2)对平衡的影响.由此可知,N2转化率最高的是b点;且T1>T2,K2>K1(T1和T2 表示温度,K1、K2表示对应温度下的平衡常数) |
D、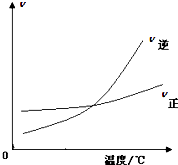 表示可逆反应“A2(g)+3B2 (g)?2AB3(g)”△H小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管编号 | 加3%Na2S2O3溶液/ml | 加H2O/ml | 加H2SO4(1:5)/滴 | 出现浑浊所用时间/s |
| ① | 3 | 3 | 5 | a |
| ② | 4 | 2 | 5 | b |
| ③ | 5 | 1 | 5 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:
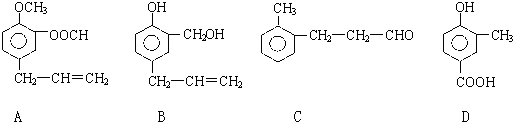

查看答案和解析>>
科目:高中化学 来源: 题型:
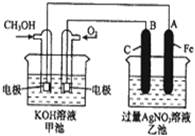
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com