
【题目】一定温度下,将a mol PCl5通入一个容积不变的密闭容器中,发生反应: PCl5(g) ![]() PCl3(g)+Cl2(g),平衡时测得混合气体的压强为P1,此时向容器中再通入a mol PCl5,在相同温度下再次达到平衡时,测得压强为P2,下列判断正确的是( )
PCl3(g)+Cl2(g),平衡时测得混合气体的压强为P1,此时向容器中再通入a mol PCl5,在相同温度下再次达到平衡时,测得压强为P2,下列判断正确的是( )
A. 2P1>P2 B. P1>P2
C. PCl5的转化率增大 D. Cl2的体积分数增大
【答案】A
【解析】
容积固定,达平衡后再向容器中充入amol PCl5,相当于增大压强,以此解答。
A. 容器容积不变,达平衡后再向容器中充入amol PCl5,相当于增大压强,平衡逆向移动,再次达到平衡时总物质的量小于原来的2倍,则平衡时压强小于原来的2倍,所以2P1>P2,故A正确;
B. 达平衡后再向容器中充入a mol PCl5,相当于增大压强,所以P1<P2,故B错误;
C. 由于平衡时再向容器中加入amol PCl5,相当于增大了压强,平衡逆向移动,所以PCl5的转化率减小,故C错误;
D. 由于平衡时再向容器中加入amol PCl5,相当于增大了压强,平衡逆向移动,氯气的体积分数减小,故D错误,答案选A。


科目:高中化学 来源: 题型:
【题目】室温下,将100mL某盐酸和硫酸的混合溶液分成两等份。一份加入过量BaCl2溶液,充分反应后得沉淀2.33g;另一份加入50mL1.0mol·L-1NaOH溶液,充分反应后溶液的 c(OH-)=0.1mol·L-1(反应后溶液的体积为100mL)。试计算:
(1)每份溶液中所含H2SO4的物质的量______________mol。
(2)原混合溶液中盐酸的物质的量浓度_____________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。下列说法不正确的是
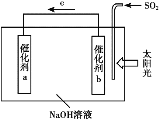
A. 该装置可将太阳能转化为化学能
B. 催化剂a表面发生还原反应,产生H2
C. 催化剂b附近的溶液pH增大
D. 吸收1 mol SO2,理论上能产生1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氯元素的非金属性比硫元素强的是( )
A. 溶解性:HCl > H2SB. Cl2+H2S→2HCl+S
C. 稳定性: HCl > H2SD. 3Cl2+2Fe![]() 2FeCl3、S+Fe
2FeCl3、S+Fe![]() FeS
FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol H2和1mol I2置于恒温恒容密闭容器中发生反应:H2(g)+I2(g)![]() 2HI(g)+9.4kJ,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是( )
2HI(g)+9.4kJ,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是( )
|
|
|
|
A | B | C | D |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药丹参中存在丹参醇。一种人工合成丹参醇的部分路线如下:

已知:![]()
完成下列填空:
(1)A中官能团的名称:__________________。
(2)D→E的反应条件:___________________。
(3)A和B生成C的反应类型是:______反应。
(4)在铜做催化剂、加热条件下,1mol丹参醇能被_____molO2氧化。
(5)B的分子式是:C9H6O3。符合下列条件的B的同分异构体有__种,写出其中能发生银镜反应的同分异构体的结构简式_____。
①苯环上直接连有一个—OH
②—OH对位上还有一个侧链,该侧链含:—C![]() C—、—COO—。
C—、—COO—。
(6)利用已知条件,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲
的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲![]() 乙
乙![]()
![]() 目标产物)。_____________
目标产物)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是( )

A. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
B. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
C. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D. 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5molNa2SO4·10H2O中所含的Na+的物质的量是________,所含的SO42-的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)12.4gNa2R含0.4molNa+,则Na2R的摩尔质量为_____,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次递增。其中A是形成化合物种类最多的元素;B原子核外有三个未成对电子;C是元素周期表中电负性最大的元素,化合物D2F为离子晶体,F原子核外的M层中只有两对成对电子;E单质的晶体类型在同周期的单质中没有相同的;G原子最外层电子数与D的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F、G用所对应的元素符号表示):
(1)C元素在元素周期表中的位置为____________________。
(2)D的氯化物的熔点比E的氯化物的熔点_____(填“高”或“低”),理由是_______。
(3)F的低价氧化物分子的立体构型是________,AO2的电子式为___________。
(4)A、B、D、E四种元素第一电离能最大的是_____。
(5)G2+能形成配离子[G(BH3)4]2+.写出该配离子的结构简式(标明配位键)_____。
(6)A能与氢、氧二种元素构成化合物AH2O,其中A原子的杂化方式为_____,1mol该分子中σ键的数目为_____,该物质能溶于水的主要原因是___________________。
(7)G晶体的堆积方式为__________________堆积,配位数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com